Avaliação de desempenho de dispositivos médicos - Visão geral
O mercado de Software as a Medical Device (SaMD) está crescendo globalmente devido a fatores como a crescente demanda por serviços de saúde remotos e a inovação futura no espaço digital de saúde. Na Europa, prevê-se que o mercado de SaMD cresça aproximadamente 27,1% durante o período de 2021 a 2027.
SaMD inclui um dispositivo médico de diagnóstico in vitro (IVD). É crucial enfatizar que os regulamentos da UE não empregam o termoSoftware as a Medical Device SaMD)". Em vez disso, utilizam o termo "Software para Dispositivos Médicos", abreviado como MDSW.
Na União Europeia (UE), os MDSW são regidos pelo Regulamento relativo aos dispositivos médicos (MDR) 2017/745 e pelo Regulamento relativo ao diagnóstico in vitro (IVDR) 2017/746. Estes regulamentos fornecem um quadro para garantir a segurança e o desempenho dos dispositivos médicos, incluindo os SaMD, no mercado da UE.
Como é que um software pode ser considerado um dispositivo médico?
Para determinar se o seu dispositivo é considerado SaMD pela UE, é necessário avaliar se o software se destina a ser utilizado para um (01) ou mais fins médicos sem fazer parte de um dispositivo médico de hardware. Se o seu software funcionar por si só para cumprir um objetivo médico, pode ser qualificado como SaMD.
No entanto, se se destinar a acionar um dispositivo médico de hardware ou for parte integrante de um, não será considerado um software autónomo e, por conseguinte, não será considerado SaMD. Certifique-se sempre de que o seu produto está em conformidade com os mais recentes regulamentos e diretrizes da UE para dispositivos médicos.
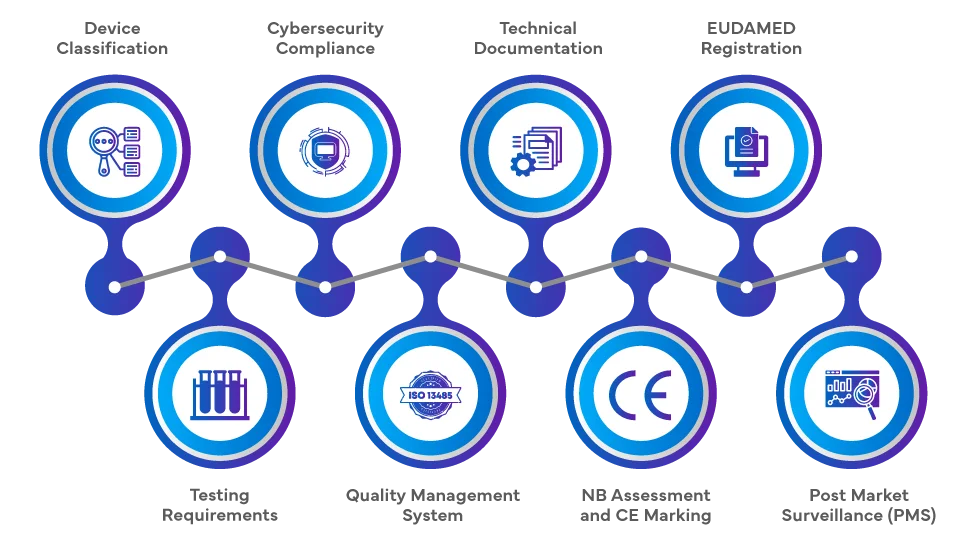
Como registar a sua SaMD na UE?
A via regulamentar para a introdução de SaMD no mercado da UE ao abrigo do EU MDR 2017/745 e do RDIV da UE 2017/746 envolve uma série abrangente de etapas. Os fabricantes devem classificar o produto de software com base na sua finalidade e nível de risco, seguido de uma avaliação de conformidade, que pode envolver um Organismo Notificado (ON) para classes de risco mais elevado. A documentação técnica, a avaliação clínica e a adesão aos Sistemas de Gestão da Qualidade (SGQ) são cruciais. Após uma avaliação bem sucedida, é aposta a marcação CE e é necessário o registo na Base de Dados Europeia sobre Dispositivos Médicos (EUDAMED). A vigilância contínua Post-market Surveillance (PMS), a vigilância e a adesão aos requisitos de cibersegurança completam o percurso regulamentar.
Perguntas frequentes (FAQs)
Um certificado EU MDR é um documento emitido por um organismo nacional designado em resultado de uma avaliação de conformidade ao abrigo do Regulamento Dispositivos Médicos da União EuropeiaEU MDR 2017/745) ou do Regulamento Diagnóstico In-Vitro (RDIV) 2017/746. Este certificado verifica se um dispositivo médico cumpre os requisitos estabelecidos no EU MDR, que inclui normas de segurança, desempenho e qualidade. O certificado é necessário para que os dispositivos médicos/dispositivos para diagnóstico in vitro sejam legalmente comercializados na UE.
Na UE, os dispositivos médicos são classificados em quatro (04) classes de risco: Classe I, Classe IIa, Classe IIb e Classe III. A Classe I representa os dispositivos com o risco mais baixo e a Classe III inclui os dispositivos com o risco mais elevado. A classificação tem em conta factores como a invasividade do dispositivo, a duração da utilização, a parte do corpo afetada e os riscos potenciais associados à conceção técnica e ao fabrico do dispositivo.
Da mesma forma, SaMD são também classificadas de acordo com o risco que representam para os doentes e utilizadores, variando de baixo risco (Classe I) a alto risco (Classe III).
O termoSoftware as a Medical Device SaMD)" é aplicado quando o software é concebido para uma (01) ou mais finalidades médicas, desempenhando essas funções de forma independente, sem ser parte integrante de um dispositivo médico de hardware. Por outro lado, "Software num dispositivo médico (SiMD)" é utilizado quando o software é integrado num equipamento médico, conhecido como software ou firmware incorporado.
É crucial enfatizar que os regulamentos da UE não empregam o termoSoftware as a Medical Device". Em vez disso, utilizam o termo "Software para Dispositivos Médicos", abreviado como MDSW.
"Software para Dispositivos Médicos (MDSW)" refere-se a software destinado a ser utilizado, isoladamente ou em combinação, para um fim descrito na definição de "Dispositivo Médico", de acordo com o EU MDR 2017/745 e o RDIV da UE 2017/746.
O tempo que demora a aprovação de um SaMD na UE pode variar significativamente em função de vários factores. Os principais factores determinantes incluem a classificação do dispositivo, a complexidade, a via de avaliação da conformidade, o envolvimento de um RN e a eficiência do processo de submissão regulamentar.
Registo SaMD nos outros mercados (UE/Austrália/Coreia) para dispositivos médicos
- Estratégia regulamentar global EU MDR para as doenças sexualmente transmissíveis.
- Apoio regulamentar e de informação sobre o mercado.
- Serviços de classificação e registo de produtos para as DMSA.
- Apoio regulamentar aos documentos de desenvolvimento de produtos SaMD .
- Serviços de consultoria sobre estudos de avaliação clínica SaMD .
- Gestão das alterações pós-aprovação.
- Serviços EAR/UKRP/CH-Rep.

- Apresentações bem sucedidas para várias classes de SaMDs.
- Pessoal dedicado e especializado para prestar apoio regulamentar.
- Apresentação atempada dos resultados.
- Acesso de afiliados locais para responder aos desafios Health Authority (HA) e aos requisitos linguísticos específicos.
- Apoio no país ou do Representante Legal (RL), com um modelo económico.
- Serviços de gestão de recursos regulamentares/aumento de efectivos.





