Protocolo de pesquisa e revisão da literatura sobre dispositivos médicos - Visão geral
No intrincado domínio dos dispositivos médicos e dos Diagnósticos In Vitro (IVD), a importância de um protocolo de pesquisa e revisão da literatura sobre dispositivos médicos bem estruturado transcende a mera exploração da investigação. Surge como uma pedra angular para alcançar a conformidade, com requisitos rigorosos de segurança e desempenho estabelecidos por regulamentos como o Regulamento de Dispositivos Médicos da União EuropeiaEU MDR) 2017/745 e o Regulamento de Diagnóstico In Vitro da União Europeia (EU IVDR) 2017/746.
Revisão da literatura sobre o EU MDR
A revisão da literatura desempenha um papel crucial na gestão do ciclo de vida de um dispositivo médico. Uma estratégia de pesquisa bibliográfica sistemática EU MDR é a espinha dorsal para o sucesso da avaliação clínica, da avaliação do desempenho, bem como da vigilância pós-comercialização e dos relatórios de acompanhamento clínico/desempenho pós-comercialização. Ancorada numa estratégia de pesquisa bibliográfica sistemática, esta revisão não é apenas uma fase, mas também um farol orientador para a tomada de decisões informadas.
O poder de uma equipa robusta de síntese da literatura científica
Os fabricantes que navegam no intrincado domínio dos dispositivos médicos e IVDs exigem mais do que uma revisão de literatura de rotina. Uma equipa robusta de síntese da literatura científica, com conhecimentos especializados na área terapêutica, é a bússola que os guia através do labirinto de requisitos regulamentares, assegurando que a conformidade não é apenas cumprida, mas, de facto, excedida.
Protocolo de pesquisa bibliográfica sobre EU MDR
As fases seguintes constituem o processo do protocolo de pesquisa bibliográfica do EU MDR :
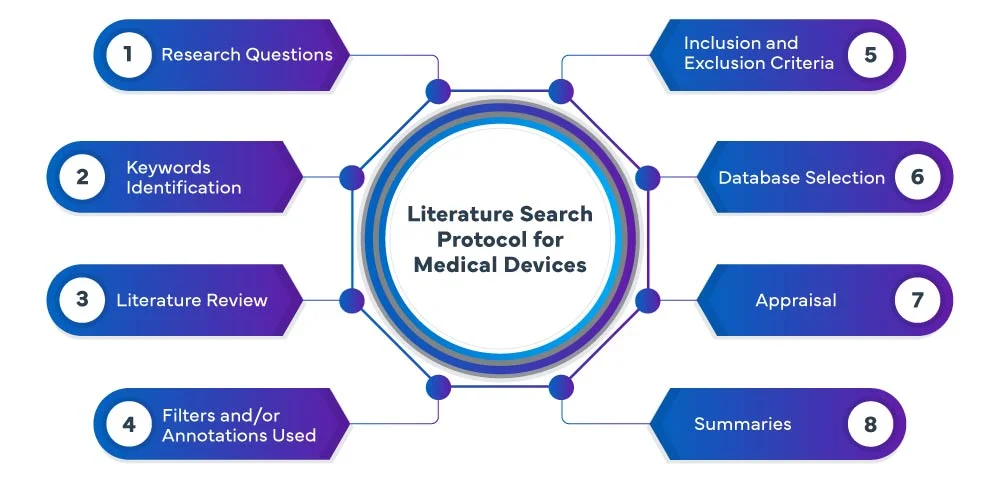
Na Freyr, efectuamos uma pesquisa sistemática e exaustiva da literatura sobre dispositivos médicos e uma revisão em várias bases de dados, incluindo PubMed, Embase e Cochrane, para identificar estudos e publicações relevantes relacionados com o seu dispositivo médico. A nossa equipa utiliza estratégias de pesquisa avançadas para garantir que recolhemos todas as provas relevantes. Analisamos e resumimos meticulosamente os resultados, fornecendo-lhe uma análise abrangente que serve de base para o processo de desenvolvimento ou avaliação do seu dispositivo.
Reconhecemos que cada dispositivo médico é único e que cada categoria de produto requer soluções personalizadas. Trabalhamos em estreita colaboração consigo para compreender os seus requisitos e fornecer-lhe serviços personalizados que satisfaçam eficazmente os seus objectivos.
Protocolo de pesquisa e revisão da literatura sobre dispositivos médicos
- Identificar, pesquisar, analisar e reunir a literatura científica adequada.
- Definição de estratégias para as cadeias de pesquisa e inclusão/exclusão de critérios.
- Identificar a base de dados adequada para o relatório de pesquisa bibliográfica, de acordo com os requisitos.
- Recolha de dados da literatura.
- Análise da literatura relevante.
- Integração de dados PMS (se aplicável).
- Documentação e elaboração de relatórios.
- Criação do Clinical Evaluation Report (CER), de acordo com os regulamentos EU MDR 2017/745 EU MDR .
- Criar um Clinical Evaluation Plan (CEP) para a sua organização.
- Realização de uma avaliação das lacunas dos CEP existentes.

- Conformidade garantida com os recentes regulamentos aplicáveis.
- Uma equipa de especialistas clínicos qualificados.
- Escalabilidade da equipa.
- Soluções adaptadas às suas necessidades.
- Contributos multifuncionais de especialistas em dispositivos médicos para cumprir os requisitos.
- Serviço de âmbito completo de conformidade, revisão e planeamento.





