
Visão geral do registo de dispositivos médicos na Europa
A UE, constituída por 27 member states , elaborou o Regulamento Dispositivos Médicos (MDR) 2017/745 e o Regulamento Dispositivos Médicos para Diagnóstico In Vitro (IVDR) 2017/746, que foram recentemente aplicados na íntegra. Estes regulamentos são parte integrante do processo de registo de dispositivos médicos na Europa e substituíram agora as diretivas. Ambos os regulamentos consistem em novos requisitos adicionais, e estes serão os procedimentos de regulamentação centralizados que serão necessários para colocar os dispositivos médicos em qualquer um dos 27 países. Os fabricantes estrangeiros de dispositivos médicos who não tenham uma localização física na Europa devem nomear um Representante Autorizado Europeu (EAR) para os ajudar a cumprir estes regulamentos.
Autoridade reguladora: Autoridade nacional competente
Regulamento: Regulamento relativo aos dispositivos médicos (MDR) 2017/745, Regulamento relativo aos dispositivos de diagnóstico in vitro 2017/746
Via de regulação: Marcação CE seguida de Registo/Notificação
Representante autorizado: Representante Autorizado Europeu (EAR) para fabricantes não comunitários
Requisito do SGQ: ISO 13485:2016
Avaliação dos dados técnicos: Organismo notificado para a marcação CE
Classificação do dispositivo
A classificação do dispositivo é o primeiro passo para determinar a via regulamentar de um determinado produto. Existem cerca de 22 regras de execução para os dispositivos médicos e são classificadas como
| Classe | Risco |
|---|---|
| Classe I | Baixo |
| Classe IIa | Moderado |
| Classe IIb | Moderado a elevado |
| Classe III | Elevado |
Do mesmo modo, para os DIV, são aplicadas cerca de 7 regras de classificação nas quatro categorias seguintes
| Classe | Risco |
|---|---|
| Classe A | Baixo |
| Classe B | Moderado |
| Classe C | Moderado a elevado |
| Classe D | Elevado |
Dadas as instruções especializadas em vigor para as diferentes classes, a identificação da classe correta de dispositivo é crucial para determinar a via regulamentar.
Representante Autorizado Europeu (EAR)
Qualquer fabricante estrangeiro que pretenda lançar os seus dispositivos na região da UE é obrigado a nomear um Representante Autorizado Europeu (EAR), em conformidade com o artigo 11º do EU MDR e do RIV EU MDR .
Registo de Dispositivos Médicos
Para comercializar os dispositivos médicos no espaço geográfico da UE, é obrigatório obter a marcação CE. Os fabricantes são obrigados a identificar e nomear os notificados, submeter-se à avaliação de conformidade e emitir a certificação CE.
A descodificação de informações regulamentares relativas ao registo ou notificação de dispositivos através de um sistema online pode revelar-se um desafio sem a assistência de um especialista.
Fluxo do processo
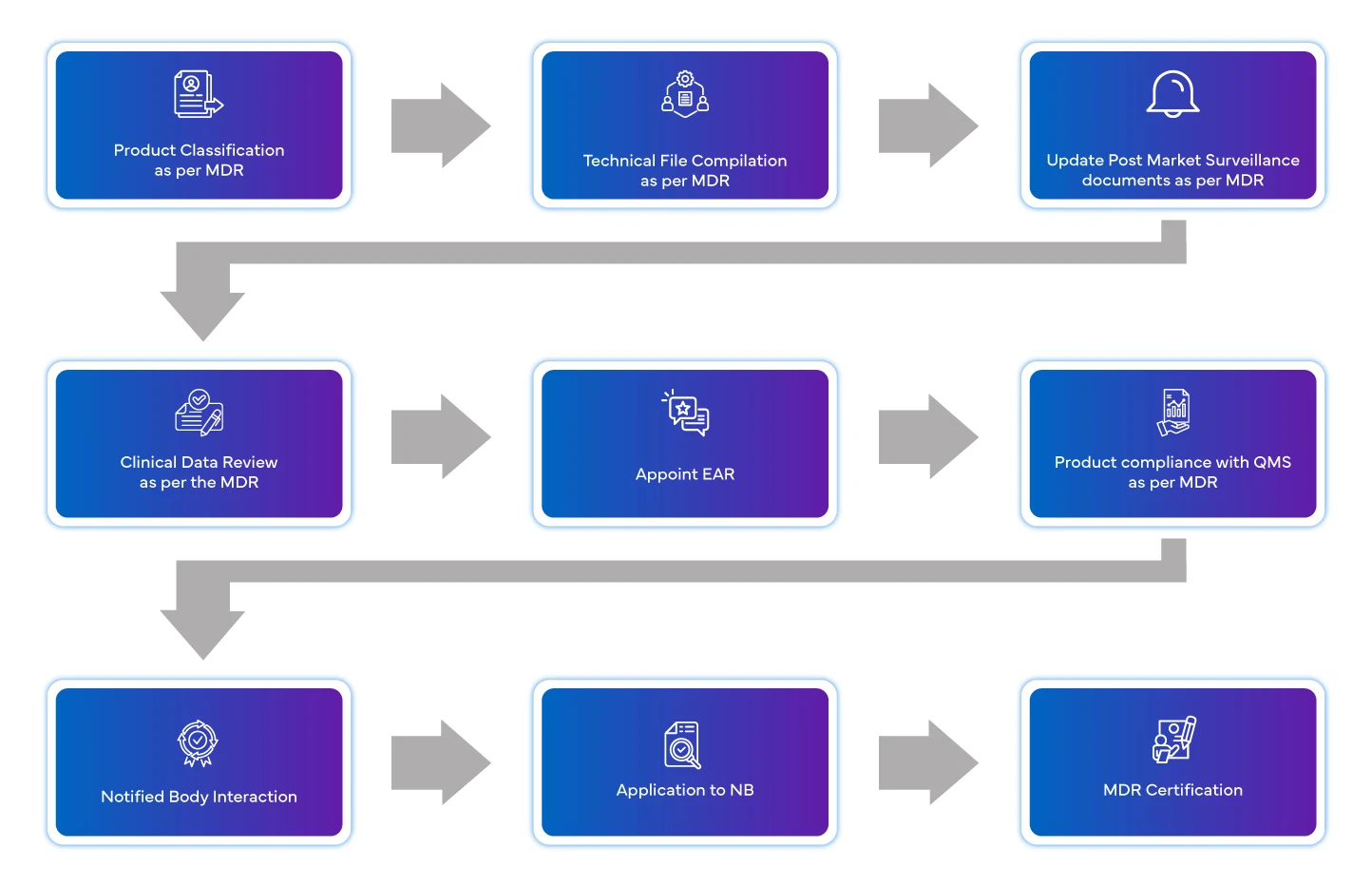
Gestão do ciclo de vida do dispositivo pós-aprovação
Os regulamentos europeus relativos aos dispositivos médicos destacam agora a importância dos requisitos pós-comercialização. O fabricante deve estar equipado com um sistema de gestão da vigilância. Deve ser fornecida uma informação periódica sobre o dispositivo.
Freyr pode apoiá-lo na elaboração do plano post-market surveillance (PMS) , do relatório de vigilância pós-comercialização (PMSR), do relatório periódico de atualização de segurança (PSUR) e do acompanhamento clínico pós-comercialização (PMCF)/acompanhamento do desempenho pós-comercialização (PMPF).
O apoio Freyr também inclui actividades como -
- Gestão de alterações pós-aprovação - alterações às aprovações de dispositivos médicos existentes, tais como, adição de novas variantes, acessórios; adição de novas indicações de utilização, entre outras
- Manutenção da certificação ISO 13485:2016 e CE
- Renovação de licenças
- Ligação entre o organismo notificado e o fabricante
Registo de Dispositivos Médicos na Europa
Especialização em Freyr
- Classificação Europeia dos Dispositivos Médicos
- Apoio do Representante Autorizado Europeu (EAR)
- ISO 14971:2019 Consulta sobre gestão de riscos
- Conformidade com a ISO 13485:2016
- Revisão, compilação e apresentação do dossiê técnico/dossiê de projeto CE
- Apoio à transição para o EU MDR
- Apoio à transição do IVDR na UE
- Clinical Evaluation Reports (CER) para dispositivos médicos
- Relatórios de avaliação do desempenho (PER) para dispositivos de diagnóstico in vitro
- Notificação/Registo de Dispositivos Médicos através do Sistema Online
- Relatório de estratégia regulamentar para dispositivos médicos
- Apoio aos ensaios - biocompatibilidade, segurança eléctrica, mecânica e desempenho
- Apoio à conformidade da rotulagem
- Apoio às BPF
- Apoio à vigilância pós-comercialização

