Visão geral do registo de dispositivos médicos no Reino Unido
Após o Brexit, o Reino Unido ainda está a alterar e a acrescentar os seus regulamentos relativos aos dispositivos médicos. Os regulamentos a serem seguidos no país são bifurcados geograficamente - Grã-Bretanha (GB) e Irlanda do Norte (NI). A Agência Reguladora de Medicamentos e Produtos de Saúde (MHRA) é a autoridade reguladora que cuida dos dispositivos médicos. A Irlanda do Norte é obrigada a cumprir os Regulamentos da União Europeia sobre Dispositivos Médicos (EU MDR) 2017/745 e os Regulamentos sobre Dispositivos de Diagnóstico In Vitro (IVDR) 2017/746. Os fabricantes não britânicos devem nomear uma Pessoa Responsável do Reino Unido (RP do Reino Unido) para os ajudar a cumprir estes regulamentos e garantir o êxito do processo de Registo de Dispositivos Médicos no Reino Unido.
Autoridade reguladora: Agência Reguladora de Medicamentos e Produtos de SaúdeMHRA)
Regulamento: Regulamentos relativos aos dispositivos médicos (MDR) 2002*
Via de regulação: Marcação CE seguida de Notificação
Representante autorizado: Pessoa responsável do Reino Unido (RP do Reino Unido) para fabricantes não britânicos
Requisito do SGQ: ISO 13485:2016
Avaliação dos dados técnicos: Organismos aprovados no Reino Unido para a marcação UKCA
Marcações válidas: GB - UKCA ou CE & NI - CE ou CE + UKNI
Formato de apresentação: Papel
Formato de apresentação: Online
*Futuros regulamentos para dispositivos médicos a aplicar a partir de 1 de julho de 2025
A Classificação de Dispositivos Médicos do Reino Unido
As classificações dos dispositivos médicos do Reino Unido baseiam-se no UK MDR 2002. A classificação do dispositivo é o primeiro passo em todo o processo de obtenção de aprovação e lançamento no mercado.
Classificação dos dispositivos médicos
| Classe | Risco |
|---|---|
| Classe I | Baixo |
| Classe IIa | Médio |
| Classe IIb | Médio |
| Classe III | Elevado |
Classificação IVD
- IVD geral
- Auto-diagnóstico dos DIV
- DIV considerados na lista A do anexo II
- DIV considerados na lista B do anexo II
A nossa empresa é especializada na classificação de dispositivos médicos. Freyr concluiu com êxito a classificação de dispositivos para mais de 50 empresas até à data no Reino Unido.
Serviços da Pessoa Responsável do Reino Unido (UKRP)
Os fabricantes não britânicos são agora obrigados a nomear obrigatoriamente o UKRP para colocar os produtos no mercado.
Freyr registou-se com sucesso e pode agora atuar como seu UKRP. Para obter mais pormenores sobre os nossos serviços UKRP, visite - www.ukrpservices.com
Registo de Dispositivos Médicos
Os fabricantes terão agora de designar um organismo aprovado pelo Reino Unido para obter a marcação UKCA. Embora a marcação CE seja permitida, só é aplicável durante um determinado período de tempo. Os calendários de transição para a mesma são mencionados a seguir
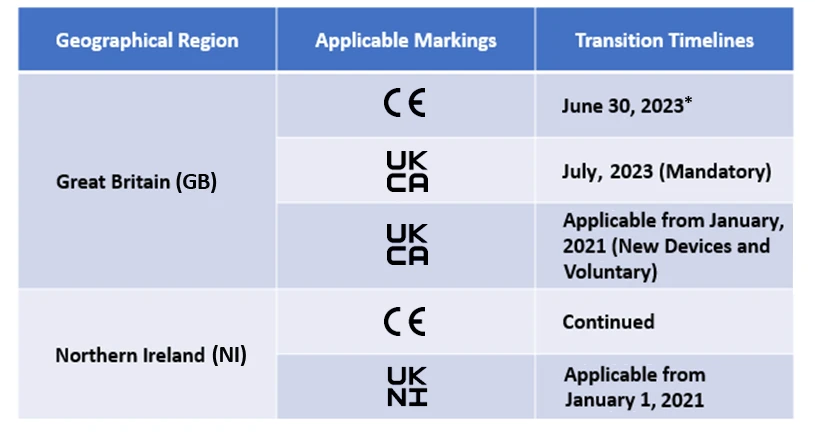
Freyr está atualmente a apoiar muitos fabricantes nas transições pós-brexit.
*O atual calendário de transição para a marcação CE ao abrigo do EU MDR é reconhecido pela MHRA do Reino Unido e os prazos serão diferentes consoante o âmbito dos dispositivos
Requisitos de vigilância pós-comercialização
Os requisitos de vigilância pós-comercialização ao abrigo do RDM 2002 do Reino Unido são bastante rigorosos para garantir a segurança e a eficácia dos doentes/utilizadores. Atualmente, as actividades de PMS incluem a comunicação de incidentes/conclusões à MHRA. A MHRA publicou orientações completas sobre o assunto.
Registo de Dispositivos Médicos no Reino Unido
Especialização em Freyr
- Classificação de Dispositivos Médicos no Reino Unido
- Apoio à transição regulamentar pós-brexit
- Apoio regulamentar à notificação MHRA do Reino Unido
- Pessoa Responsável do Reino Unido (UKRP)
- Ligação e apoio da agência de saúde e do organismo aprovado