
Visão geral do registo de dispositivos médicos no Vietname
O mercado de dispositivos médicos do Vietname está a recuperar e é atualmente um dos sectores em expansão no país. Os dispositivos médicos no país são regulamentados pelo Departamento de Equipamentos Médicos e Obras de Saúde (DMEHW) do Ministério da Saúde. Os fabricantes estrangeiros devem nomear um Representante Autorizado Local no Vietname para os ajudar no processo de registo de dispositivos médicos no Vietname.
Autoridade reguladora: Departamento de Equipamento Médico e Obras de Saúde (DMEHW)
Regulamento: Decreto n. 98/2021/ CP
Representante autorizado: Vietname Representante autorizado local
Requisito do SGQ: ISO 13485:2016
Avaliação dos dados técnicos: Departamento de Equipamento Médico e Construção (DMEC) do Ministério da Saúde
Labelling : Decreto n.º. 111/2021
Formato de apresentação: Online- Prazos: 15 - 60 dias
Língua: Inglês e vietnamita
Classificação dos dispositivos médicos no Vietname
Os dispositivos são classificados em 4 classes (A, B, C e D), que também são categorizadas em dois grupos, o grupo 1 (Classe A) e o grupo 2 (Classes B, C e D). A classificação formal está disponível no Departamento de Equipamento Médico e Obras de Saúde do Vietname (DMEHW).
| Grupo | Classe | Risco |
|---|---|---|
Grupo 1 | Classe A | Nível baixo |
Grupo 2 | Classe B | Nível médio de risco mais baixo |
Classe C | Nível médio superior de riscos | |
Classe D | Elevado nível de riscos |
Vietname Representante autorizado local
A nomeação de um agente vietnamita fiável e capaz para os fabricantes estrangeiros é crucial, uma vez que estes devem assumir os serviços de garantia oferecidos pelo fabricante como parte da venda do dispositivo. A tradução para vietnamita é indispensável para entrar na região, o que, na prática, pode ser um desafio.
Freyr oferece apoio regulamentar que abrange toda a gama de actividades, tais como a aquisição do Número de Reconhecimento de Venda Livre envolvido na aprovação de Dispositivos Médicos pelas autoridades. Também fornecemos apoio linguístico especializado para manter intacta a perspetiva regulamentar da tradução. Atendemos às necessidades pós-aprovação dos clientes para manter a conformidade durante todo o ciclo de vida do produto no Vietname.
Registo de dispositivos médicos no Vietname
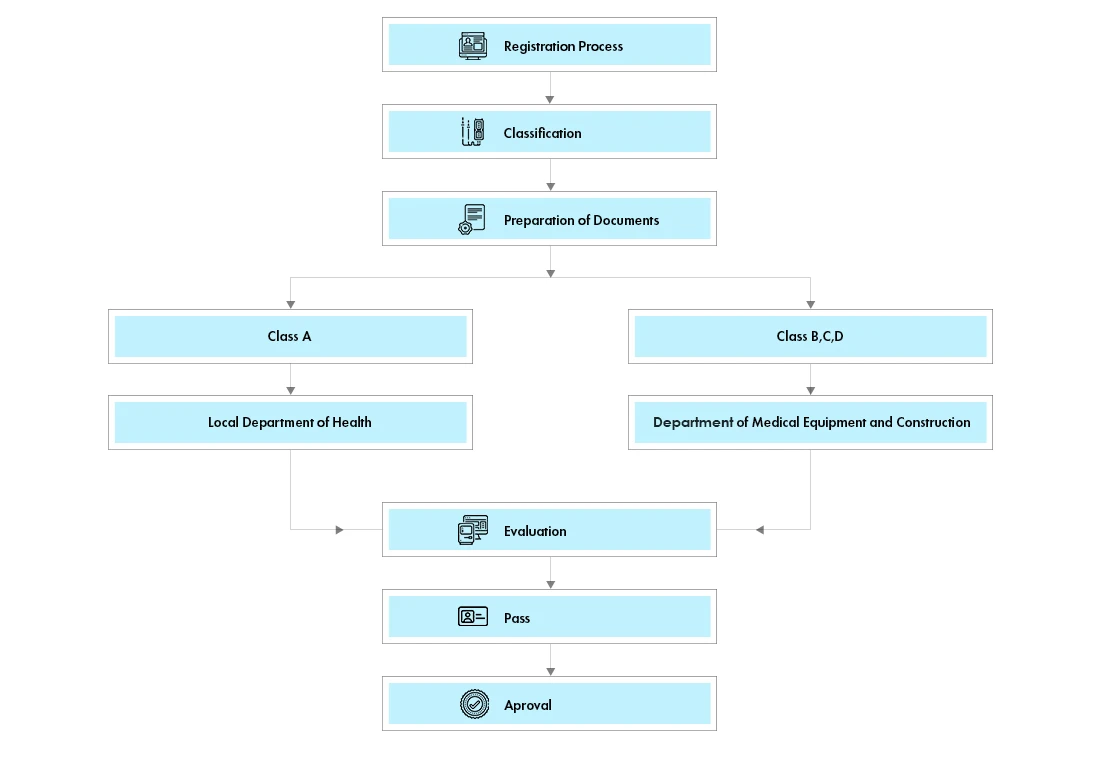
Todos os produtos das Classes A e B necessitam de uma Licença de Autorização de Comercialização (MA). Os dispositivos das Classes A e B serão submetidos a uma análise administrativa rápida pelo Departamento de Saúde da província onde o Titular do Registo está localizado.
Os dispositivos das classes C e D terão agora de se candidatar a uma licença de Autorização de Comercialização (MA). As licenças MA permanecerão válidas indefinidamente.
Fluxo do processo
Gestão do ciclo de vida do dispositivo pós-aprovação
Freyr os fabricantes estrangeiros na gestão end-to-end do ciclo de vida dos dispositivos end-to-end , incluindo atividades pós-aprovação, tais como:
- Gestão de alterações pós-aprovação - alterações às aprovações de Dispositivos Médicos existentes, tais como, adição de novas variantes, acessórios; adição de novas indicações de utilização, entre outras
- Manutenção das aprovações e do registo através do pagamento atempado das taxas administrativas e de registo
- Renovação de licenças
- Ligação entre o DMEHW e o fabricante
- Gestão das importações
Resumo
Grupo | Classe | Risco | Via de regulação | Cronogramas | Validade |
|---|---|---|---|---|---|
Grupo 1 | Classe A | Nível baixo | Declaração da norma aplicável | 15 - 60 dias | Ilimitado |
Grupo 2 | Classe B | Nível médio de risco mais baixo | Certificado de registo de venda livre | 15 - 60 dias | 5 anos |
Classe C | Nível médio superior de riscos | Certificado de registo de venda livre | 15 - 60 dias | 5 anos | |
Classe D | Elevado nível de riscos | Certificado de registo de venda livre | 15 - 60 dias | 5 anos |
Especialização em Freyr
- Diligência devida regulamentar
- Classificação oficial
- Registo do dispositivo
- Licença de importação
- Apoio à rotulagem
- Apoio à tradução
- Identificação e qualificação de distribuidores
- Vigilância pós-comercialização
- Gestão de alterações pós-aprovação
- Renovação e transferência de licenças
- Apresentação e contacto
- Desembaraço aduaneiro

