Clinical evaluation report (CER) para dispositivos médicos Descrição geral
Qualquer dispositivo destinado a ser comercializado na União Europeia (UE) deve ostentar uma marca CE. De acordo com o EU MDR 2017/745, os requisitos para um Clinical Evaluation Report (CER), incluindo requisitos de processo e dados, variam com base na classe de um dispositivo e são necessários para obter a certificação CE de dispositivos médicos. Os dispositivos de baixo risco da classe I podem efetuar a autocertificação CE. Em contrapartida, as outras classes de dispositivos (IIa, IIb, III) têm de processar a certificação da marca CE através de um Organismo Notificado (ON) acreditado. O fabricante deve apresentar o ficheiro técnico CE ao ON para avaliação e emissão da aprovação da marca CE e emissão do certificado CE. O Clinical Evaluation Report (CER) dos dispositivos médicos deve ser apresentado juntamente com o dossier técnico CE para cumprir os requisitos da marcação CE.
O Clinical Evaluation Report (CER) para dispositivos médicos é um dos relatórios que devem ser apresentados juntamente com o dossier técnico CE para cumprir os requisitos do RCE.
O que é um Clinical Evaluation Report (CER)?
A redação de relatórios de avaliação clínica inclui a avaliação e análise de dados clínicos relativos a um dispositivo médico para verificar a sua segurança e desempenho clínicos. A avaliação clínica de dispositivos médicos baseia-se na análise exaustiva de dados clínicos pré e pós-comercialização relevantes para a utilização prevista. O relatório de avaliação clínica inclui dados específicos do dispositivo, bem como quaisquer dados relativos a dispositivos considerados equivalentes pelo fabricante.
Um relatório de avaliação clínica consiste em literatura científica e dados clínicos analisados que foram recolhidos a partir de uma investigação clínica do seu dispositivo ou dos resultados de outros estudos sobre dispositivos substancialmente equivalentes. O RCE de um dispositivo médico demonstra que o dispositivo atinge o objetivo pretendido sem expor os utilizadores e os doentes a riscos adicionais.
O RCE EU MDR deve ser atualizado todos os anos. No caso de o dispositivo ser comercializado durante um período significativo e estar comprovadamente seguro, sem riscos significativos, o RCE pode ser atualizado a cada 2-5 anos. Quaisquer alterações introduzidas na conceção do dispositivo e quaisquer novas informações provenientes de dados PMS podem desencadear uma atualização do relatório RCE.
A avaliação clínica dos dispositivos médicos, tal como enquadrada no Clinical Evaluation Report (CER), baseia-se nos factores abaixo indicados.
- Literatura científica atualmente disponível; e/ou
- Investigações clínicas efectuadas; ou
- Se a demonstração da conformidade com os requisitos essenciais com base em dados clínicos não é considerada adequada.
Fases da redação Clinical Evaluation Report (CER)
De acordo com o novo Regulamento relativo aos Dispositivos Médicos da UE (MDR) - 2017/745, existem quatro (04) fases diferentes para efetuar uma avaliação clínica de Dispositivos Médicos para preparar um Clinical Evaluation Report (CER)RCE) MDR da UE abrangente.
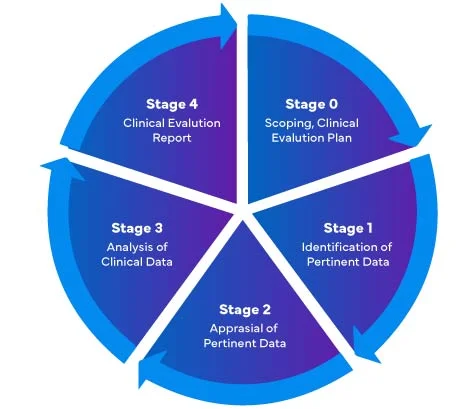
Os fabricantes de Dispositivos Médicos que entram no mercado da UE pela primeira vez devem garantir que o seu Relatório de Avaliação Clínica está em conformidade com os regulamentos EU MDR .
Freyr serviços end-to-end de certificação end-to-end para fabricantes de dispositivos, incluindo a elaboração de relatórios de avaliação clínica em conformidade com os regulamentos EU MDR recentemente implementados. Com forte experiência regional em dispositivos médicos da UE, Freyr aos requisitos das agências e personaliza o relatório de avaliação clínica de acordo com eles.
Obtenha aconselhamento especializado sobre a sua apresentação de RCE
Clinical evaluation report (CER)
- Apoio na elaboração de relatórios de avaliação End-to-end , incluindo pesquisa bibliográfica, de acordo com a norma MEDDEV 2.7/1 revisão 4 e as diretrizes do Regulamento Europeu sobre Dispositivos Médicos (MDR).
- Elaborar um plano de avaliação clínica para a sua organização.
- Identificar, pesquisar, analisar e reunir a literatura científica adequada aplicável.
- Desenvolver um modelo de Relatório de Avaliação Clínica para a sua organização.
- Análise das lacunas do relatório de avaliação clínica existente.
- Ferramenta DMS para que a sua equipa contribua coletivamente para a redação do Relatório de Avaliação Clínica.
- Integração de dados PMS.
- Desenvolva um procedimento operacional normalizado para a sua equipa compilar dados da PMS para atualizar os Relatórios de Avaliação Clínica.
- Tratamento das actualizações periódicas dos relatórios de avaliação clínica existentes, de acordo com as diretrizes MDR da UE.
- Suporte de dados PMS para dispositivos existentes no mercado.
- Conformidade com a marcação CE e serviços de marcação CE.

- Conformidade garantida com os recentes regulamentos aplicáveis.
- Equipa de especialistas clínicos qualificados.
- Contribuições multifuncionais de especialistas em Dispositivos Médicos para cumprir os requisitos.
- Serviço de âmbito completo de conformidade, revisão e planeamento.




