Colômbia Visão geral do registo de dispositivos médicos
A Colômbia apresenta enormes oportunidades para as empresas de dispositivos médicos e o seu sistema de saúde é reconhecido pelo seu empenho na segurança dos doentes e na qualidade dos serviços médicos e rege os dispositivos médicos através do INVIMA (Instituto Nacional de Vigilância de Alimentos e Medicamentos). O INVIMA é a autoridade operacional para o registo de dispositivos médicos na Colômbia.

Autoridade reguladora: INVIMA (Instituto Nacional de Vigilância dos Alimentos e dos Medicamentos)
Regulamento: Decreto 4725/2005
Via de regulação: Registo do dispositivo
Representante autorizado: Colômbia Representante legal
Requisito do SGQ: ISO 13485:2016 / MDSAP
Avaliação dos dados técnicos: INVIMA
Requisitos de rotulagem: Os documentos de rotulagem devem ser redigidos em língua espanhola
Validade da licença: 10 anos
Formato de apresentação: Eletrónico
Colômbia Classificação de dispositivos médicos
| Classificação dos dispositivos médicos | |
|---|---|
| Classe I (Risco mais baixo) | |
| Classe IIa | |
| Classe IIb | |
| Classe III (risco mais elevado) | |
Colômbia Representante legal
Para ser um Representante Legal na Colômbia, é necessário ter cidadania colombiana ou possuir a autorização legal necessária para residir e trabalhar no país como estrangeiro. Um Representante Legal pode ajudar e gerir todos os procedimentos de registo na Colômbia, actuando como elo de ligação entre a empresa e a INVIMA, a autoridade reguladora local.
Colômbia Registo de Dispositivos Médicos
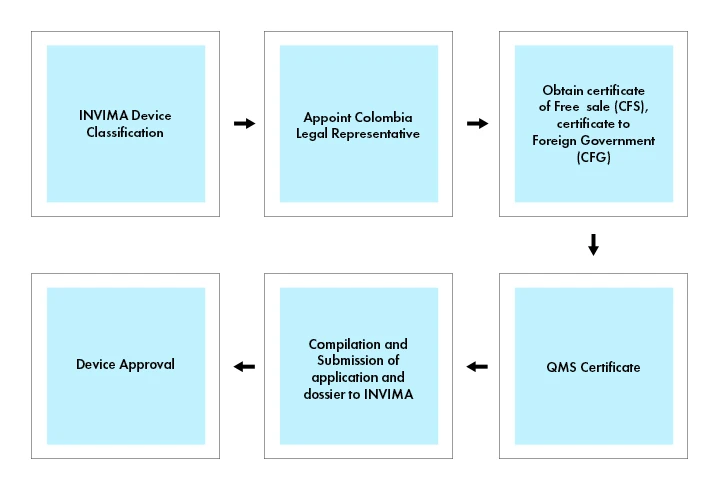
Os Dispositivos Médicos e os IVDs estão sujeitos a um procedimento de registo, pelo que os Dispositivos Médicos têm de ser registados no INVIMA para serem comercializados na Colômbia.
Para comercializar um dispositivo médico na Colômbia, é necessário obter um Certificado de Venda Livre (CFS) ou um Certificado para Governo Estrangeiro (CFG) emitido pela agência reguladora apropriada no país de origem ou por um país de referência reconhecido (por exemplo, Canadá, Japão, Austrália, União Europeia e Estados Unidos). O Certificado de Venda Livre ou Certificado para o Governo Estrangeiro serve como prova de que o dispositivo médico cumpre as normas de segurança e qualidade necessárias para venda na Colômbia.
Fluxo do processo
Gestão do ciclo de vida do dispositivo pós-aprovação
Freyr os fabricantes estrangeiros na gestão end-to-end do ciclo de vida dos dispositivos end-to-end , incluindo atividades pós-aprovação, tais como:
- Gestão de alterações pós-aprovação - alterações às aprovações de dispositivos médicos existentes, tais como, adição de novas variantes, acessórios; adição de novas indicações de utilização, entre outras
- Manutenção das aprovações e do registo através do pagamento atempado das taxas administrativas e de registo
- Renovação de licenças
- Ligação entre o INVIMA e o fabricante
Resumo
| Classificação dos dispositivos médicos | Novas licenças e renovações | ||
|---|---|---|---|
| Novo registo | Alteração | Renovação | |
| Classe I | 4-6 meses | 2-3 meses | 4-6 meses |
| Classe IIa | 4-6 meses | 2-3 meses | 4-6 meses |
| Classe IIb | 4-6 meses | 2-3 meses | 4-6 meses |
| Classe III | 4-6 meses | 2-3 meses | 4-6 meses |
| Taxas de registo | |||||
|---|---|---|---|---|---|
| Novas licenças e renovações | Alterações técnicas | Alterações administrativas | |||
| Classe I e Classe IIa | Classe IIb e Classe III | Classe I e Classe IIa | Classe IIb e Classe III | Classe I e Classe IIa | Classe IIb e Classe III |
| $ 690,00 | $ 776,00 | $ 196,00 | $ 196,00 | $ 153,00 | $ 153,01 |
Especialização em Freyr
- Diligência devida regulamentar
- Classificação oficial
- Registo do dispositivo
- Colômbia Titular do registo
- Apoio à rotulagem
- Apoio à tradução
- Identificação e qualificação de distribuidores
- Vigilância pós-comercialização
- Gestão de alterações pós-aprovação
- Renovação e transferência de licenças
- Apresentação e ligação com o INVIMA