Visão geral do registo de dispositivos médicos no Egito
Desde setembro de 2018, o registo de dispositivos médicos passou a ser obrigatório no Egito. A indústria de dispositivos médicos no país tem testemunhado um crescimento consistente, tornando um mercado atraente para fabricantes e distribuidores. Com uma avaliação de US $ 4,0 bilhões em 2021, o mercado egípcio de dispositivos médicos deve atingir uma taxa composta de crescimento anual (CAGR) de mais de 3% de 2022 a 2027. A importação atende amplamente à demanda por dispositivos médicos no Egito, dada a produção local relativamente baixa. De forma notável, o mercado egípcio de dispositivos médicos é o segundo maior da região do Médio Oriente e do Norte de África (MENA). Esta visão geral explora os principais aspectos do processo de registo no Egito, oferecendo uma perspetiva do quadro regulamentar e dos requisitos para colocar dispositivos médicos inovadores na vanguarda do sector dos cuidados de saúde do Egito.
Autoridade reguladora: Autoridade Egípcia de Medicamentos (EDA)
Regulamento: Lei egípcia sobre dispositivos médicos Lei n.º 10 de 2003
Percurso regulamentar: Registo do produto (normal e acelerado) e classificação oficial
Egito Representante autorizado local: Titular do Registo Egípcio (ERH)
Requisito do SGQ: ISO 13485
Avaliação dos dados técnicos: O Centro de Planeamento e Política de Medicamentos (DPPC) e a Administração Central dos Assuntos Farmacêuticos (CAPA).
Validade da licença: Dez (10) anos
Formato de apresentação: Papel e eletrónico
Tradução: Documentos traduzidos em árabe e inglês
Classificação do dispositivo
No Egito, a classificação dos dispositivos médicos está alinhada com o sistema europeu de classificação, que categoriza os dispositivos médicos com base na sua utilização prevista e nos potenciais riscos associados à sua utilização. Os fabricantes devem identificar a classificação correta dos seus dispositivos para garantir a conformidade com os requisitos regulamentares e para obter as aprovações necessárias para a comercialização e distribuição no Egito.
Classes de dispositivos médicos
| Classe | Risco |
|---|---|
| Classe I | Baixo |
| Classe II a | Baixo-Médio |
| Classe II b | Médio-Alto |
| Classe III | Elevado |
Egito Representante autorizado local
As empresas de dispositivos médicos sediadas fora do Egito devem designar um Agente Local denominado "Egyptian Registration Holder (ERH)" para tratar da apresentação de pedidos de registo e dossiers à EDA em seu nome. O ERH funciona como um elo de ligação entre o fabricante e a autoridade reguladora, assegurando a preparação e apresentação exactas de toda a documentação necessária e verificando se o dispositivo médico cumpre as normas de segurança, qualidade e eficácia da EDA. Além disso, o titular do registo egípcio é responsável pela preservação da documentação de registo, pela comunicação de incidentes ou recolhas e por garantir a adesão contínua a todas as normas e regulamentos aplicáveis ao longo do ciclo de vida do dispositivo. O Titular de Registo Egípcio (ERH) é inteiramente responsável por assegurar o registo de um dispositivo médico junto da EDA, particularmente no âmbito da Administração Central de Dispositivos Médicos. Esta função implica garantir a conformidade do dispositivo com os requisitos regulamentares da EDA para comercialização e distribuição no Egito.
Registo de Dispositivos Médicos
A obtenção Autorização de Introdução no Mercado um dispositivo médico no Egito envolve várias etapas, incluindo a preparação da documentação necessária, o envio da submissão EDA, o cumprimento dos requisitos de classificação e do sistema de qualidade, a nomeação de um ERH, se necessário, e o cumprimento das obrigações pós-comercialização. O processo de registo é crucial para garantir que os dispositivos médicos estejam em conformidade com os padrões de segurança, qualidade e eficácia estabelecidos pela Autoridade Reguladora Egípcia. A documentação necessária pode variar de acordo com o caminho de registo escolhido, mas geralmente inclui o seguinte:
- Certificado CE (se aplicável).
- Certificado de venda livre (CFS).
- Certificação ISO 13485 .
- Declaração de Conformidade (DOC).
Fluxo do processo
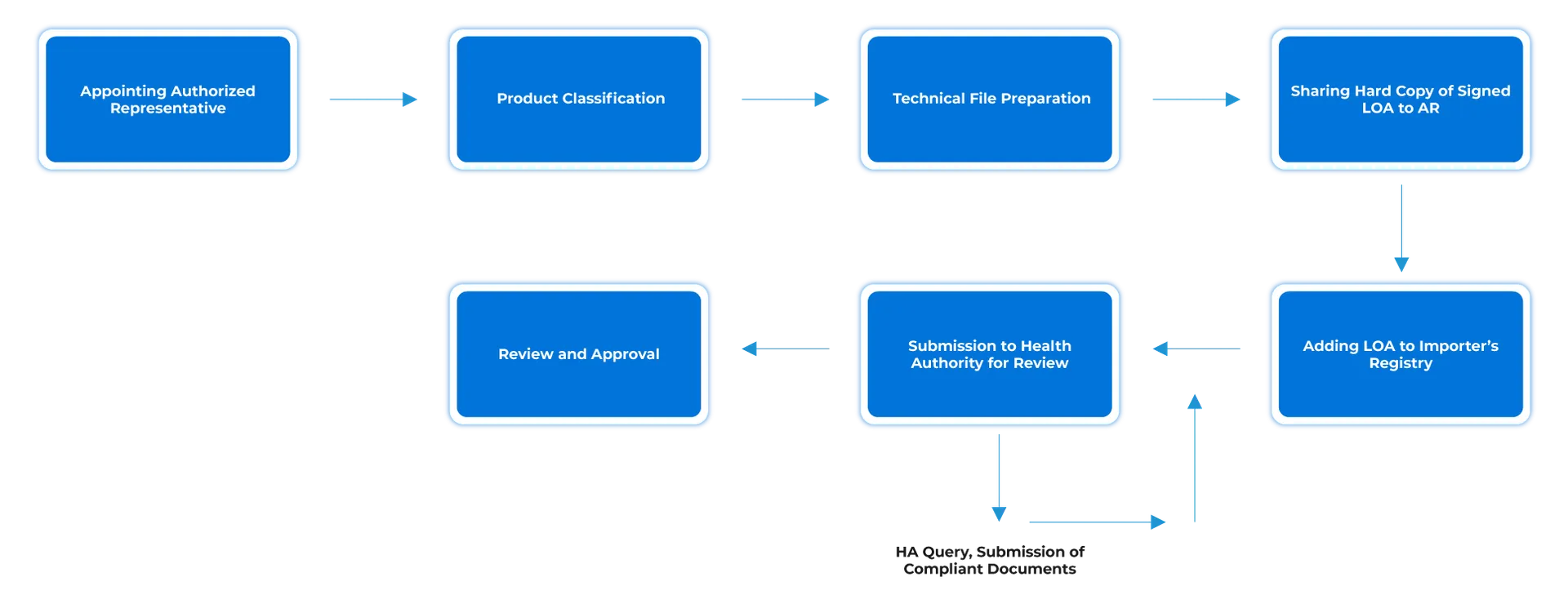
Gestão do ciclo de vida do dispositivo pós-aprovação
Freyr presta um apoio abrangente aos fabricantes estrangeiros na gestão de todo o ciclo de vida dos dispositivos médicos no Egito, incluindo actividades pós-aprovação:
- Gestão de alterações pós-aprovação, abordando modificações às aprovações de dispositivos médicos existentes, tais como a adição de novas variantes, acessórios e indicações de utilização.
- Manutenção da ISO 13485:2016.
- Certificação CE.
- Atuar como intermediário entre o Organismo Notificado (ON) e o fabricante.
- Um sistema de vigilância em vigor para monitorizar a segurança do dispositivo médico após a concessão Autorização de Introdução no Mercado.
- Fornecer actualizações periódicas sobre a segurança e a eficácia do dispositivo médico, bem como quaisquer alterações no estatuto regulamentar noutras jurisdições.
- Renovação da Autorização de Introdução no Mercado, dependendo do tipo de dispositivo e dos regulamentos, após um determinado período.
Gerir eficazmente a Post-market Surveillance (PMS) no Egito implica navegar habilmente pelos quadros regulamentares definidos pela EDA. Os novos operadores que se debatem com estas complexidades e que não dispõem de um parceiro regulamentar estabelecido podem tirar partido dos extensos serviços regulamentares oferecidos pela Freyr. Estes serviços contribuem para um processo de aprovação sem falhas dos dispositivos médicos no Egito, garantindo a conformidade contínua com o panorama regulamentar e a dinâmica do mercado em constante evolução.
Especialização em Registo de Dispositivos Médicos no Egito
- Informação regulamentar.
- Diligência devida regulamentar.
- Classificação dos dispositivos médicos.
- Registo do dispositivo.
- Titular do registo egípcio.
- Apoio à tradução.
- Escrita médica.
- Apoio à rotulagem.
- Identificação e qualificação de distribuidores.
- Gestão de alterações pós-aprovação.
- Renovação e transferência de licenças.
- Desembaraço aduaneiro.
