
Registo de dispositivos médicos na Indonésia Visão geral
A Indonésia iniciou a prestação de cuidados de saúde universais aos seus cidadãos em 2014. Este facto influenciou grandemente o crescimento do mercado dos dispositivos médicos e levou ao aumento da importação de dispositivos médicos. Os dispositivos na Indonésia são regulados pela Agência Nacional de Controlo de Medicamentos e Alimentos (NADFC), que funciona sob a alçada do Ministério da Saúde da Indonésia (MoH). O último regulamento em vigor para a importação de dispositivos médicos é o Decreto n.º 62, imposto no ano de 2017. As empresas estrangeiras devem nomear um representante local autorizado da Indonésia para o processo de registo de dispositivos médicos na Indonésia.
Autoridade reguladora: Agência Nacional de Controlo de Medicamentos e Alimentos (NADFC)
Regulamento: N.º 62 / 2017
Representante autorizado: Indonésia Representante autorizado local
Requisito do SGQ: ISO 13485:2016
Avaliação dos dados técnicos: NADFC
Validade da licença: 5 anos
Requisitos de rotulagem: N.º 62 / 2017
Formato de apresentação: Online
Língua: Inglês e indonésio
Classificação dos dispositivos médicos na Indonésia
O regulamento atual classifica os dispositivos como A, B, C e D com base no risco.
| Critérios de risco | Classe de dispositivos |
|---|---|
| Baixo risco | A |
| Baixo Moderado Risco | B |
| Risco moderado - elevado | C |
| Risco elevado | D |
Indonésia Representante autorizado local
A regulamentação indonésia exige que os fabricantes nomeiem um representante local com uma licença de distribuidor. Pode ser nomeado um distribuidor para representar o fabricante estrangeiro na Indonésia. No entanto, a nomeação de um terceiro independente proporcionaria flexibilidade para mudar de distribuidor ou nomear vários distribuidores para uma melhor penetração no mercado.
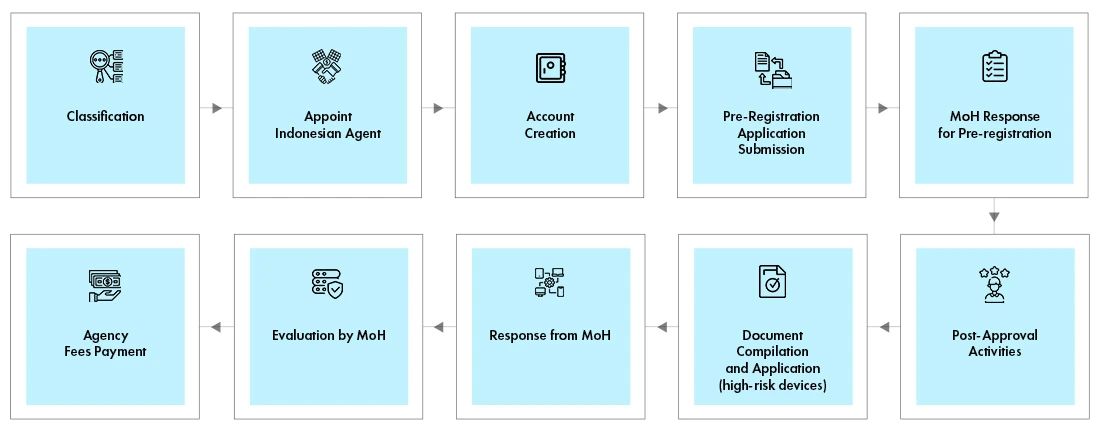
Registo de Dispositivos Médicos na Indonésia
O representante local deve criar uma conta no online . O processo de registo é o mesmo para todas as classes de dispositivos. No entanto, os requisitos de documentação variam de acordo com a classe do dispositivo. O registo é um processo em duas etapas –
- Processo de pré-registo
- Processo de avaliação
O Ministério da Saúde verifica a classificação do dispositivo e determina o custo da avaliação. O resultado do pré-registo, juntamente com a fatura, é enviado por correio eletrónico ao requerente. O representante local, em nome do fabricante, efectua o pagamento e carrega o comprovativo de pagamento. O MoH analisará os documentos e partilhará os resultados por correio eletrónico com o requerente. Alguns dispositivos requerem testes no país num laboratório acreditado.
Visão geral do processo de aprovação regulamentar
A equipa de especialistas Freyracompanha as mudanças nas tendências e regulamentações e ajuda as partes interessadas a manter a conformidade regulamentar ao longo do ciclo de vida do produto. Oferecemos soluções regulamentares para manter outros aspetos regulamentares de conformidade dentro dos orçamentos limitados.
Classe do dispositivo | Classe de risco | MoH Cronogramas para Autorização de Introdução no Mercado | MoH Cronogramas para Renovação / Variação | ||
|---|---|---|---|---|---|
| Processo de classificação (dias) | Processo de avaliação (dias) | Processo de classificação (dias) | Processo de avaliação (dias) | ||
| Classe A | Baixo risco | 7 | 45 | 7 | 45 |
| Classe B | Baixo Moderado Risco | 7 | 90 | 7 | 45 |
| Classe C | Risco moderado - elevado | 7 | 100 | 7 | 45 |
| Classe D | Risco elevado | 7 | 120 | 7 | 45 |
Especialização em Freyr
- Diligência devida regulamentar
- Registo do dispositivo
- Testes no país
- Licenciamento de distribuidores
- Legalização e Notarização
- Representante legal
- Labelling
- Apoio à tradução
- Identificação e qualificação de distribuidores
- Serviços de vigilância pós-comercialização
- Gestão de alterações pós-aprovação
- Serviços de renovação e transferência de licenças
- Serviços de apresentação e de ligação

