Visão geral do registo de dispositivos médicos em Israel
A indústria de dispositivos médicos de Israel está a registar um crescimento sustentado e inovação, tornando-se um centro de tecnologias de ponta na área da saúde. O registo de dispositivos médicos é crucial para as empresas que entram neste mercado dinâmico. Esta visão geral explora os principais aspectos do processo de registo em Israel, oferecendo uma perspetiva do quadro regulamentar e dos requisitos para trazer dispositivos médicos inovadores para a vanguarda do sector de cuidados de saúde de Israel.
Autoridade reguladora: A Divisão de Dispositivos Médicos do Ministério da Saúde de Israel (AMAR).
Regulamento: Lei dos dispositivos/equipamentos médicos de 2012
Percurso regulamentar: Registo do produto
Representante autorizado local de Israel: Titular do Registo de Israel (IRH)
Requisito do SGQ: ISO 13485
Avaliação dos dados técnicos: O Departamento de Dispositivos Médicos do Ministério da Saúde
Validade da licença: Cinco (05) anos
Formato de apresentação: Papel e eletrónico
Tradução: Documentos traduzidos em hebraico
Classificação do dispositivo
A Lei de Equipamentos Médicos e os Regulamentos para o Registo de Equipamentos Médicos em Israel não especificam um sistema de classificação de risco. Em vez disso, Israel alinha a sua classificação de dispositivos médicos com as normas internacionais, particularmente as delineadas pelos países da Global Harmonization Task Force (GHTF). Em alternativa, a classificação de risco de um dispositivo num país reconhecido é adoptada para registo em Israel. Este processo de classificação considera normalmente a utilização prevista, o nível de risco e outros factores que podem ter impacto na segurança e eficácia dos dispositivos médicos.
Classes de dispositivos médicos
| Classe | Risco |
|---|---|
| Classe I | Baixo |
| Classe II | Baixo-Médio |
| Classe III | Elevado |
Alterações propostas às vias de registo
As alterações propostas aplicam-se aos dispositivos das classes I e II, enquanto o sistema de registo dos dispositivos da classe III permanece inalterado.
- Os dispositivos da classe I podem ser imediatamente registados através de autodeclaração.
- Para dispositivos de Classe II, embora sejam necessárias declarações e documentos técnicos, a AMAR pode acelerar o processo para catorze (14) dias para aqueles considerados de risco baixo a médio. Isso se aplica se o fabricante possuir duas (02) autorizações de países reconhecidos e fornecer seis (06) meses de dados de mercado. Alternativamente, para dispositivos de Classe II com apenas a autorizaçãoFDA (k)FDA US e seis (06) meses de dados US , o tempo de processamento da AMAR é acelerado para sessenta (60) dias.
Israel Representante autorizado local
As empresas de dispositivos médicos sediadas fora de Israel devem designar um Titular de Registo Israelita (IRH) para facilitar o registo dos seus produtos para venda no país. O IRH actua como representante local do fabricante e é responsável pela ligação com o Ministério da Saúde para garantir o cumprimento dos regulamentos locais. Além disso, um IRH é responsável por estabelecer e manter uma presença comercial em Israel, bem como por obter e manter uma licença comercial válida.
Registo de Dispositivos Médicos
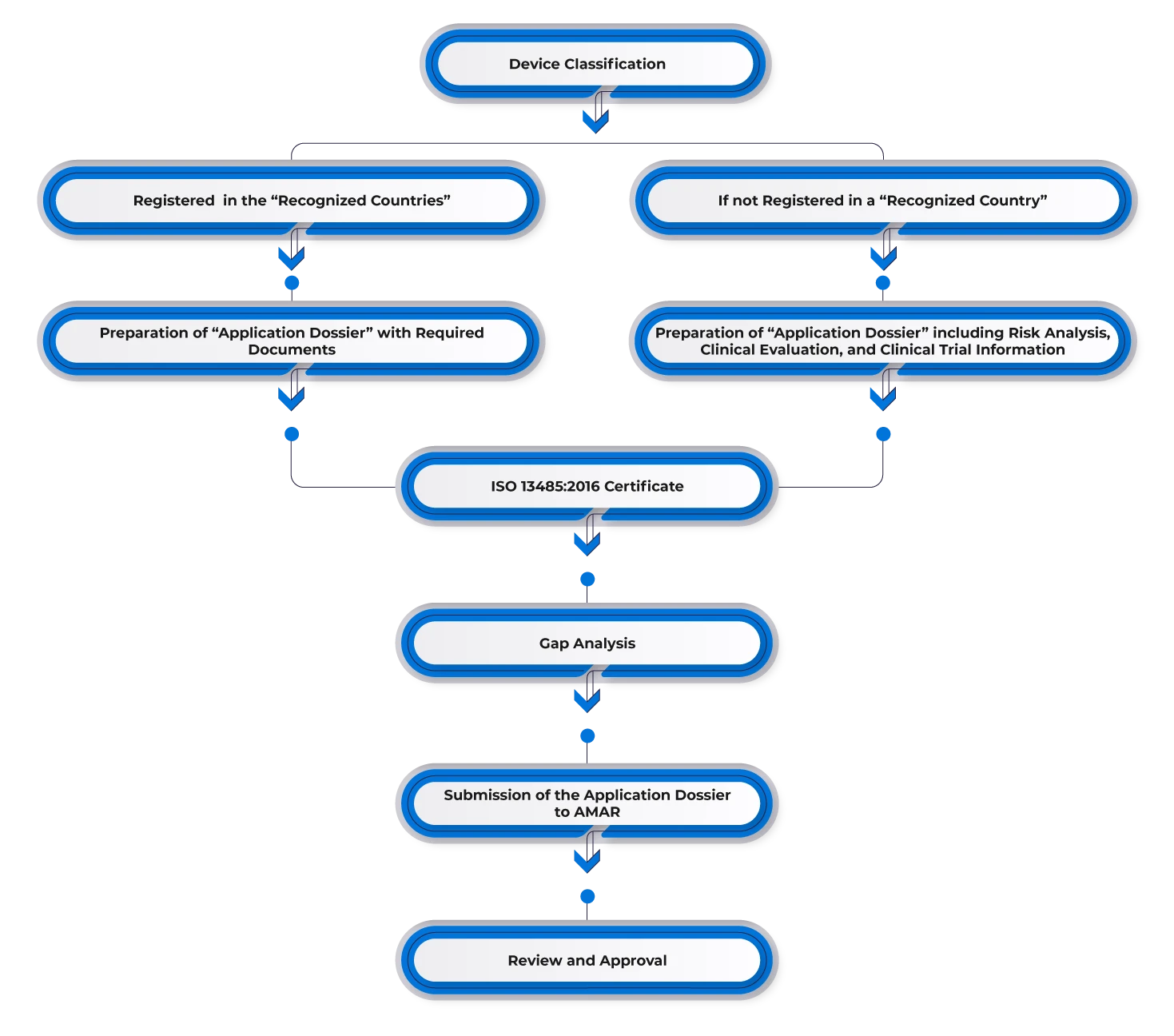
Para registar um dispositivo médico em Israel, os fabricantes devem obter uma aprovação prévia num dos mercados de referência, como os EUA, a Europa, a Austrália, o Canadá ou outros mercados importantes. Os fabricantes com aprovações existentes num dos países de referência podem utilizar essa aprovação para o mercado israelita e nomear um representante no país. Posteriormente, devem apresentar a documentação necessária, incluindo:
- Carta de aprovação FDA 510(k)/Pré-comercialização/CE.
- Certificado para Governo Estrangeiro (CFG)/Certificado de Venda Livre (CFS).
- Certificação ISO 13485 ou outra certificação reconhecida de boas práticas de fabrico (BPF).
- Validação e certificação do Instituto de Normalização de Israel (se necessário).
Fluxo do processo
Gestão do ciclo de vida do dispositivo pós-aprovação
Freyr presta um apoio abrangente aos fabricantes estrangeiros na gestão de todo o ciclo de vida dos dispositivos médicos em Israel, incluindo actividades pós-aprovação:
- Gestão de alterações pós-aprovação, abordando modificações às aprovações de dispositivos médicos existentes, tais como a adição de novas variantes, acessórios e indicações de utilização.
- Manutenção da certificação ISO 13485:2016 e CE.
- Renovação de licenças.
- Atuar como intermediário entre o Organismo Notificado (ON) e o fabricante.
Navegar pelas complexidades dos órgãos de autorização e cumprir vários conjuntos de regulamentos para aprovações de dispositivos pode ser um desafio. Obter aprovações de vários países da GHTF e aderir aos regulamentos estaduais requer um conhecimento regulatório aprofundado. Para os participantes do mercado que enfrentam essas complexidades sem um parceiro regulatório estabelecido, Freyr serviços end-to-end , simplificando o processo de aprovação de dispositivos médicos em Israel.
Especialização em Registo de Dispositivos Médicos no Egito
- Classificação de Dispositivos Médicos de Israel.
- Titular do Registo de Israel (IRH).
- Israel Registo de dispositivos.
- ISO 14971:2019 Consulta sobre gestão de riscos.
- Conformidade com ISO 13485:2016.
- Revisão, compilação e envio do dossiê de design.
- Registo de dispositivos médicos através do sistema Online .
- Relatório sobre a estratégia de regulamentação dos dispositivos médicos.
- Suporte de testes - Biocompatibilidade, Segurança Eléctrica, Mecânica e Desempenho.
- Apoio à conformidade da rotulagem.
- Suporte GMP.
- Apoio Post-market Surveillance (PMS) .
