Visão geral do registo de dispositivos médicos na Nova Zelândia
Os dispositivos médicos na Nova Zelândia são regulamentados pela Autoridade de Segurança dos Medicamentos e Dispositivos Médicos da Nova Zelândia (Medsafe), de acordo com os Regulamentos sobre Medicamentos de 1984, a Lei dos Medicamentos de 1981 e os Regulamentos sobre Medicamentos (Base de dados de dispositivos médicos) de 2003. Embora não seja necessária uma aprovação prévia à comercialização, é necessário incluir os produtos na base de dados do sistema de notificação eletrónica de dispositivos assistida pela Web (WAND) no prazo de 30 dias após o lançamento comercial. A Medsafe pode solicitar documentação que comprove a segurança e a eficácia, como a certificação de organismos reconhecidos, como um organismo notificado da UE ou Health Canada.
A equipa de especialistas em regulamentação de dispositivos médicos da Freyr possui uma experiência considerável na orientação de empresas de dispositivos médicos através do processo de registo Medsafe para dispositivos médicos na Nova Zelândia.

Autoridade reguladora: Autoridade para a Segurança dos Dispositivos Médicos (Medsafe)
Regulamento:The Medicines (Database of Medical Devices) Regulations, 2003
Medicines Act 1981
Medicines Regulation 1984
Via de regulação: Sistema eletrónico de notificação de dispositivos assistida pela Web (WAND)
Representante autorizado: Dispositivo médico Patrocinador
Requisito do SGQ: Certificação ISO 13485:2016
Avaliação dos dados técnicos: Autoridade para a Segurança dos Dispositivos Médicos (Medsafe)
Validade da licença: As listas de dispositivos na Nova Zelândia não expiram. Os dispositivos considerados uma grande ameaça para o público podem ser retirados do mercado.
Requisitos de rotulagem: Regulamento 12(4) dos Medicines Regulations 1984 e GHTF/SG1/N43:2005
Formato de apresentação: Sistema eletrónico de notificação de dispositivos assistida pela Web (WAND)
Língua: Inglês
Classificação dos dispositivos médicos da Nova Zelândia
Os dispositivos médicos na Nova Zelândia são classificados por risco nas classes I, IIa, IIb, III e AIMD, de acordo com os critérios do Fórum Internacional de Reguladores de Dispositivos Médicos (IMDRF). Esta classificação afecta a quantidade de controlo regulamentar necessário. A classificação baseia-se em caraterísticas como a finalidade pretendida do dispositivo, a duração do contacto com o corpo, a invasividade e o facto de estar ativo ou inativo. Os dispositivos de classe superior estão sujeitos a um controlo regulamentar mais rigoroso. A Medsafe é a entidade reguladora na Nova Zelândia que supervisiona estas classificações e regulamentos.
| Classificação Medsafe dos dispositivos médicos com exceção dos DIV Classe | Risco |
|---|---|
| Classe I Básica | Baixo risco |
| Medição de classe I | Baixo risco |
| Estéril de classe I | Baixo risco |
| Classe IIa | Risco baixo-médio |
| Classe IIb | Risco médio-alto |
| Dispositivos médicos implantáveis activos e de classe III (AIMD) | Risco elevado |
| Classificação Medsafe IVD | Risco |
|---|---|
| A partir de julho de 2014, a Medsafe não reconhece qualquer sistema de classificação de risco para os DIV. Todos os IVDs notificados à WAND devem utilizar o código de classificação de risco do IVD. O Diretor-Geral da Saúde autorizou a isenção para os DIV de acordo com o Anexo 1, parágrafo (i) dos Regulamentos de Medicamentos (Base de Dados de Dispositivos Médicos) de 2003. Mas os fornecedores de DIV podem notificar voluntariamente os seus dispositivos à base de dados. | |
Representante/Patrocinador Autorizado para Dispositivos Médicos
O Representante Autorizado é designado por Patrocinador e actua como intermediário entre o fabricante e a Medsafe. Os Promotores são os representantes regulamentares dos produtos comercializados na Nova Zelândia, submetendo pedidos WAND e actuando como ponto de contacto principal entre o fabricante e a Medsafe para todos os assuntos relacionados com o produto. Além disso, a Medsafe responsabiliza o Promotor pelos esforços de vigilância.
Registo de Dispositivos Médicos na Nova Zelândia
O registo de dispositivos médicos, o procedimento na Nova Zelândia e o procedimento de listagem WAND na Nova Zelândia variam consoante a classe do dispositivo.
Dispositivos da classe I - É necessária uma declaração de conformidade do fabricante para os equipamentos não esterilizados e de não medição da classe I; no entanto, raramente é apresentada a um organismo regulador. Em vez disso, o promotor (ou fornecedor) deve introduzir os dados do dispositivo na base de dados WAND (Web Assisted Notification of Devices) como parte do processo de notificação Medsafe.
Outros dispositivos de classe
Na Nova Zelândia, os promotores ou fornecedores têm a tarefa de garantir que os dispositivos médicos cumprem normas como ISO 13485:2016. A apresentação direta de uma Declaração de Conformidade, certificação QMS ou provas de fabrico à Medsafe não é normalmente exigida. No entanto, a retenção desta documentação é crucial para provar a conformidade quando solicitada.
A Medsafe dá prioridade à vigilância pós-comercialização em detrimento da aprovação detalhada dos dispositivos médicos antes da comercialização. Embora as auditorias não sejam realizadas por rotina durante a fase de notificação, a Medsafe pode iniciá-las para dispositivos de risco mais elevado ou na sequência de actividades de vigilância e relatórios de eventos adversos, garantindo segurança e conformidade contínuas.
Assim que um dispositivo é notificado através da base de dados WAND, pode ser comercializado na Nova Zelândia, desde que o fornecedor cumpra sistematicamente os regulamentos da Medsafe. Isto exige uma conformidade contínua, particularmente com as normas de monitorização pós-comercialização e de comunicação de incidentes. Os especialistas em dispositivos médicos da Freyr apoiam os serviços relacionados com a navegação nestes requisitos regulamentares, assegurando que as empresas mantêm a conformidade durante todo o ciclo de vida do produto.
Fluxo do processo
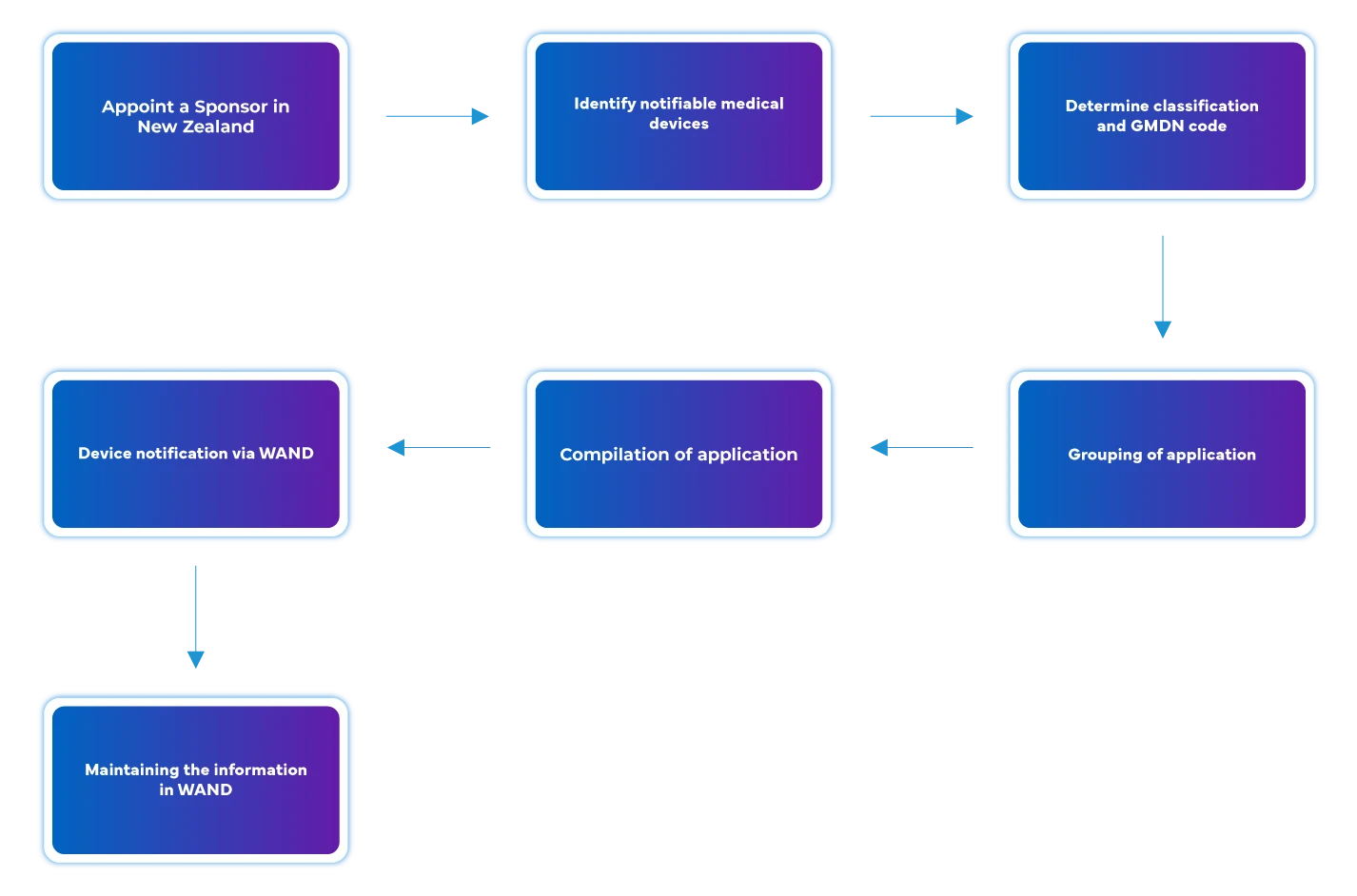
Gestão do ciclo de vida do dispositivo pós-aprovação
A Freyr apoia fabricantes estrangeiros na gestão end-to-end do ciclo de vida de dispositivos end-to-end , incluindo atividades pós-aprovação, notificando as autoridades da Nova Zelândia através do WAND, tais como:
- Gestão de alterações pós-aprovação - alterações às aprovações de Dispositivos Médicos existentes, tais como, adição de novas variantes, acessórios; adição de novas indicações de utilização, entre outras.
- Manutenção das aprovações e dos registos.
Equipada com uma equipa de profissionais da área regulamentar, Freyr oferece um apoio abrangente aos fabricantes para manterem os padrões de qualidade e segurança necessários para a aprovação do mercado. Os especialistas em inteligência regulamentar da empresa monitorizam meticulosamente as actualizações dos regulamentos, garantindo que os clientes estão bem informados sobre as acções necessárias para manter a conformidade dos seus produtos com as normas actuais.
Resumo
| Risco | Classe de dispositivos | Auditoria do SGQ | Via de regulação | Prazos Medsafe | Validade do registo (anos) |
|---|---|---|---|---|---|
| Baixo risco | Classe I Básica | Conformidade com a ISO 13485:2016 Nota - A Medsafe não exige auditorias do SGQ, mas recomenda vivamente que se siga ISO 13485:2016 em termos de qualidade e segurança. A Medsafe tem autoridade para efetuar auditorias ao SGQ de qualquer classe de dispositivos se surgirem preocupações de segurança ou qualidade. | Listagem WAND (Notificação) | 1 semana |
Sem datas de validade |
| Baixo risco | Medição de classe I | Listagem WAND (Notificação) | |||
| Baixo risco | Estéril de classe I | Listagem WAND (Notificação) | |||
| Risco baixo-médio | Classe IIa | Listagem WAND (Notificação) | |||
| Risco médio-alto | Classe IIb | Listagem WAND (Notificação) | |||
| Risco elevado | Classe III | Listagem WAND (Notificação) |
Nota: De acordo com a legislação atual, as listas de dispositivos na Nova Zelândia não expiram, mas os dispositivos que se considere representarem um risco inaceitável para o público podem ser retirados do mercado. No entanto, a legislação atual poderá ser revista até 2026/2027.
Especialização em Freyr
- Apoio ao registo de dispositivos médicos de ponta a ponta.
- Suporte LR
- Listagem WAND
- Apoio à rotulagem
- Gestão de alterações pós-aprovação
- Transferência de licença
- Serviços de apresentação e de ligação com a WAND
