
Visão geral do registo de dispositivos médicos em Taiwan
Taiwan tem uma procura crescente de dispositivos médicos. A Taiwan Food & Drug Administration (TFDA) do Ministério da Saúde e do Bem-Estar (MOHW) regula os Dispositivos Médicos através da Pharmaceutical Affairs Act (PAA). Os fabricantes estrangeiros sem escritório físico em Taiwan requerem a representação de um agente de Taiwan como pré-requisito para o processo de registo de Dispositivos Médicos em Taiwan.
Autoridade reguladora: Administração de Alimentos e Medicamentos de Taiwan
Regulamento: Lei dos Assuntos Farmacêuticos (PAA) e Regulamento para o registo de Dispositivos Médicos
Representante autorizado: É necessária a representação de um agente de Taiwan
Requisito do SGQ: Documentação do Sistema de Qualidade (QSD) ISO 13485
Avaliação dos dados técnicosa: Divisão de Dispositivos Médicos e Cosméticos
Validade da licença: QSD - 3 anos; Registo do produto - 5 anos
Requisitos de rotulagem: Artigo 75.º da Lei dos Assuntos Farmacêuticos
Formato de apresentação: Papel
Língua: Inglês e chinês
Classificação de Dispositivos Médicos de Taiwan
A TFDA classifica os dispositivos médicos em 3 classes com base no risco: Classe -I para dispositivos de baixo risco, Classe II para dispositivos de risco moderado e Classe III para dispositivos de alto risco. A necessidade de um dispositivo de referência constitui um desafio para a entrada de novos dispositivos no mercado. O aumento do tempo de procedimento para dispositivos de Classe II e III que necessitam de documentação do sistema de qualidade é outra complexidade envolvida. Todos os dispositivos médicos importados devem obter um certificado de registo da TFDA
| Classe de dispositivos | Risco |
|---|---|
| Classe I | Baixo risco |
| Classe II | Risco moderado |
| Classe III | Risco elevado |
Representação de agentes em Taiwan
Os fabricantes estrangeiros sem escritórios físicos em Taiwan devem nomear um agente de Taiwan como pré-requisito para comercializar dispositivos em Taiwan. A nomeação de uma organização terceira como Agente de Taiwan em vez de distribuidor dá flexibilidade para explorar vários distribuidores para uma melhor penetração no mercado. O Agente de Taiwan deve ter uma entidade legal estabelecida em Taiwan, certificada com uma Licença de Vendas Farmacêuticas.
Registo de Dispositivos Médicos em Taiwan
Antes de um Dispositivo Médico poder ser vendido em Taiwan, é necessário o registo da Documentação do Sistema de Qualidade (QSD) para as instalações de fabrico, para além do registo do Dispositivo Médico. O registo QSD só é dispensado para Dispositivos Médicos de Classe I (não esterilizados). Uma licença QSD (recebida após a aprovação do registo QSD) em Taiwan, é semelhante às Boas Práticas de Fabrico (BPF) para Dispositivos Médicos.
A TFDA anunciou que, a partir de 1 de junho de 2022, os titulares de licenças de dispositivos médicos de classe III são obrigados a carregar a UDI e as informações correspondentes sobre o produto na base de dados UDI (UDID). Os fabricantes de dispositivos médicos também são obrigados a colocar o UDI no rótulo do produto. Além disso, a partir de 1 de junho de 2023, os dispositivos médicos da Classe II são obrigados a cumprir os regulamentos relevantes da UDI.
Fluxo do processo
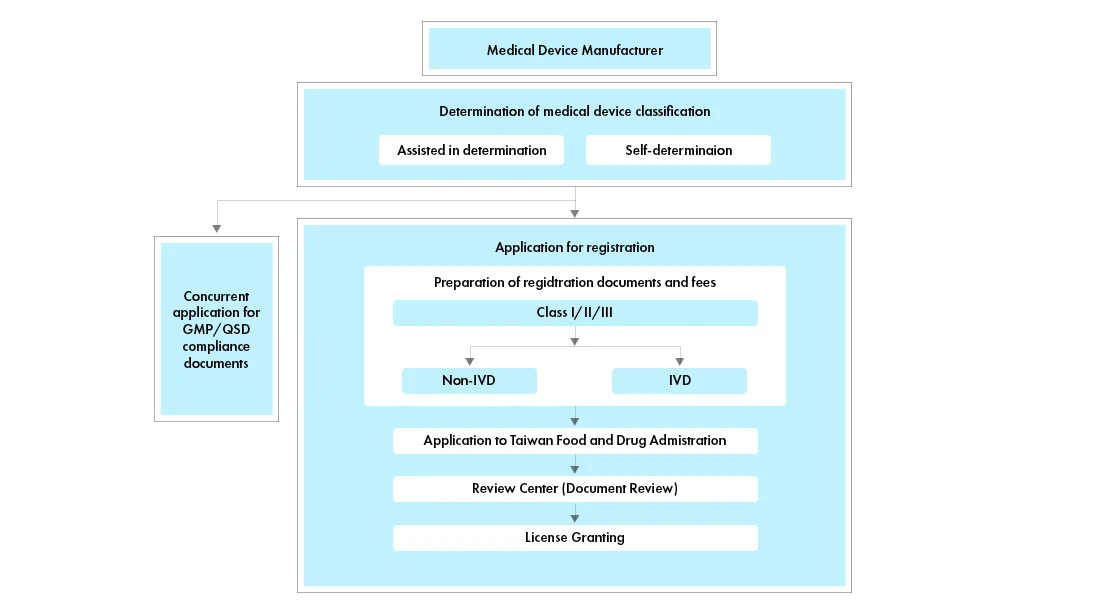
Gestão do ciclo de vida dos dispositivos médicos pós-aprovação
Freyr os fabricantes estrangeiros na gestão end-to-end do ciclo de vida dos dispositivos end-to-end , incluindo atividades pós-aprovação, tais como:
- Gestão de alterações pós-aprovação - alterações às aprovações de Dispositivos Médicos existentes, tais como, adição de novas variantes, acessórios; adição de novas indicações de utilização, entre outras
- Manutenção das aprovações e do registo através do pagamento atempado das taxas administrativas e de registo
- Renovação de licenças
- Ligação entre a TFDA e o fabricante
- Gestão das importações
Freyr em atender às necessidades regulatórias de dispositivos médicos em Taiwan. Com uma extensa rede, Freyr na nomeação de um agente local confiável, cuja presença é de extrema importância durante toda a Vigilância Pós-Comercialização. Nossos especialistas também auxiliam na seleção de dispositivos predicados adequados e aprovações existentes em outros mercados para apoiar a entrada de novos dispositivos no mercado.
Resumo
| Classe de dispositivos | Critérios de risco / classificação | SGQ | Registo do produto |
|---|---|---|---|
| Classe I | Baixo risco | Isentos (dispositivos não esterilizados da classe I) | Sim |
| Classe II | Risco moderado | QSD | Sim |
| Classe III | Risco elevado | QSD | Sim |
Especialização em Freyr
- Diligência devida regulamentar
- Classificação oficial
- Aprovações QSD
- Registo do dispositivo
- Representante legal
- Apoio à rotulagem
- Apoio à tradução
- Identificação e qualificação de distribuidores
- Vigilância pós-comercialização
- Gestão de alterações pós-aprovação
- Renovação e transferência de licenças
- Apresentação e contacto

