
Visão geral do registo de dispositivos médicos na Turquia
O mercado turco de dispositivos médicos registou um crescimento significativo e consistente ao longo da última década. A partir de 2021, o registo de dispositivos médicos da Turquia exige o cumprimento do Regulamento Dispositivos Médicos da UE (MDR) 2017/745 e do Regulamento Dispositivos Médicos para Diagnóstico In Vitro (IVDR) 2017/746. Este facto reforçou o comércio internacional, levando várias empresas mundiais a lançar os seus dispositivos médicos no país.
Autoridade reguladora: Agência Turca de Medicamentos e Dispositivos Médicos (TITCK)
Regulamento: Regulamento relativo aos dispositivos médicos (MDR) 2017/745, Regulamento relativo aos dispositivos de diagnóstico in vitro 2017/746
Via de regulação: A marcação CE é obrigatória, seguida do registo/notificação no Sistema de Acompanhamento de Produtos (UTS)
Turquia Representante autorizado local: Representante Europeu Autorizado (EAR) para fabricantes estrangeiros (não pertencentes à UE/não pertencentes à Turquia)
Requisito do SGQ: ISO 13485:2016
Avaliação dos dados técnicos: Organismo notificado para a marcação CE
Validade da licença: Ilimitado
Formato de apresentação: Papel
Tradução: Documentos traduzidos em turco
Classificação do dispositivo
A Turquia segue a mesma classificação de dispositivos médicos que a do EU MDR e do IVDR EU MDR . Determinar a classificação do dispositivo pode ser um desafio e, por isso, ter o apoio de um consultor regulamentar experiente é crucial neste domínio.
Classes de dispositivos médicos -
| Classe | Risco |
|---|---|
| Classe I | Baixo |
| Classe IIa | Moderado |
| Classe IIb | Moderado a elevado |
| Classe III | Elevado |
Classes de dispositivos de diagnóstico in vitro
| Classe | Risco |
|---|---|
| Classe A | Baixo |
| Classe B | Moderado |
| Classe C | Moderado a elevado |
| Classe D | Elevado |
Turquia Representante autorizado local
Atualmente, devido ao acordo de união aduaneira, os fabricantes da UE não precisam de nomear um representante local autorizado para colocar os seus dispositivos no mercado.
Outros fabricantes estrangeiros são obrigados a nomear um Representante Autorizado Europeu (EAR) para colocar os dispositivos no mercado turco.
Registo de Dispositivos Médicos
A marcação CE é uma conformidade exigida pelos fabricantes para colocarem o seu dispositivo no mercado turco. A marcação CE é emitida através de uma avaliação de conformidade efectuada pelo organismo notificado. Atualmente, a Turquia está autorizada a nomear organismos notificados em conformidade com o EU MDR e o RDIV EU MDR .
As empresas são obrigadas a registar-se no Sistema de Registo Central (MERSIS) e a registar o dispositivo no Sistema de Acompanhamento de Produtos (UTS).
Fluxo do processo
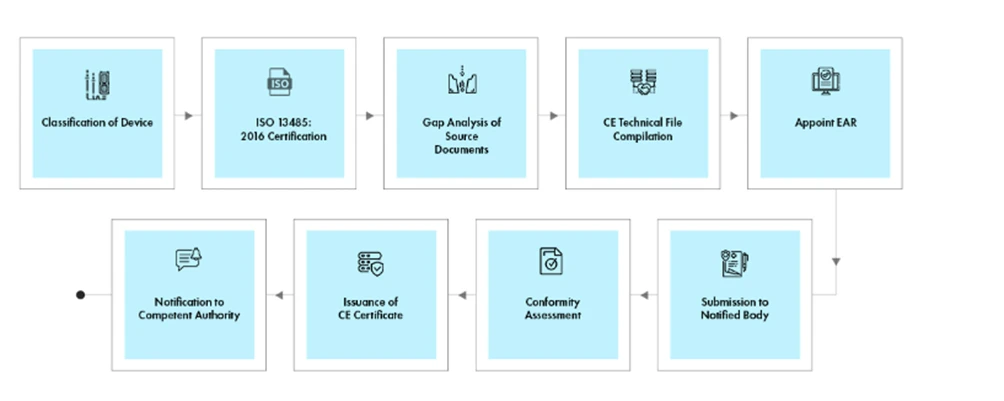
Gestão do ciclo de vida do dispositivo pós-aprovação
A Freyr apoia fabricantes estrangeiros na gestão end-to-end do ciclo de vida de dispositivos end-to-end , incluindo atividades pós-aprovação, tais como:
- Gestão de alterações pós-aprovação - alterações às aprovações de dispositivos médicos existentes, tais como a adição de novas variantes, acessórios; adição de novas indicações de utilização, entre outras
- Manutenção da certificação ISO 13485:2016 e CE
- Renovação de licenças
- Ligação entre o organismo notificado e o fabricante
Com vários órgãos de autorização envolvidos, os fabricantes estrangeiros precisam cumprir vários conjuntos de regulamentos em cada processo individual para aprovação de dispositivos. Obter a marcação CE e cumprir os regulamentos estaduais requer um amplo conhecimento regulatório. Às vezes, sem um parceiro regulatório comprovado, navegar por todos os requisitos do dispositivo pode ser um desafio para os novos participantes do mercado. Para ajudar os fabricantes, a Freyr fornece serviços end-to-end para agilizar as aprovações de dispositivos médicos.
Especialização em Freyr
- Classificação Europeia dos Dispositivos Médicos
- Apoio do Representante Autorizado Europeu (EAR)
- Turquia Registo de dispositivos e notificação de produtos
- ISO 14971:2019 Consulta sobre gestão de riscos
- Conformidade com a ISO 13485:2016
- Revisão, compilação e apresentação do dossiê técnico/dossiê de projeto CE
- Apoio à transição para o EU MDR
- Apoio à transição do IVDR na UE
- Clinical Evaluation Reports (CER) para dispositivos médicos
- Relatórios de avaliação do desempenho (PER) para dispositivos de diagnóstico in vitro
- Notificação/Registo de Dispositivos Médicos através do Sistema Online
- Relatório de estratégia regulamentar para dispositivos médicos
- Apoio aos ensaios - biocompatibilidade, segurança eléctrica, mecânica e desempenho
- Apoio à conformidade da rotulagem
- Apoio às BPF
- Apoio à vigilância pós-comercialização

