Auditoria de conformidade farmacêutica e serviços de validação
Aproveite uma década de proficiência com os nossos serviços através de avaliações de conformidade, auditorias meticulosas e processos de validação robustos.
Procurar tópicos
- O que é a Conformidade, Auditoria e Validação no sector farmacêutico?
- Qual é a importância da Conformidade, Auditoria e Validação na indústria farmacêutica?
- Principais desafios no domínio da conformidade, auditoria e validação
- O que são auditorias GxP?
- Compreender as auditorias remotas
- O que é a Validação do Sistema Informático (CSV) e porque é que é crucial na indústria farmacêutica?
- Em que é que a CSV difere da Garantia do Sistema Informático (CSA)?
- Quais são os componentes de um programa CSA?
- Como é que a CSA contribui para a integridade dos dados na indústria farmacêutica?
- Que papel desempenha a conformidade regulamentar na CSA?
- Como é que um parceiro estratégico de conformidade regulamentar pode ajudar?
- Porquê escolher Freyr?
- Os nossos serviços
O que é a Conformidade, Auditoria e Validação no sector farmacêutico?
Última atualização em: setembro, 2024
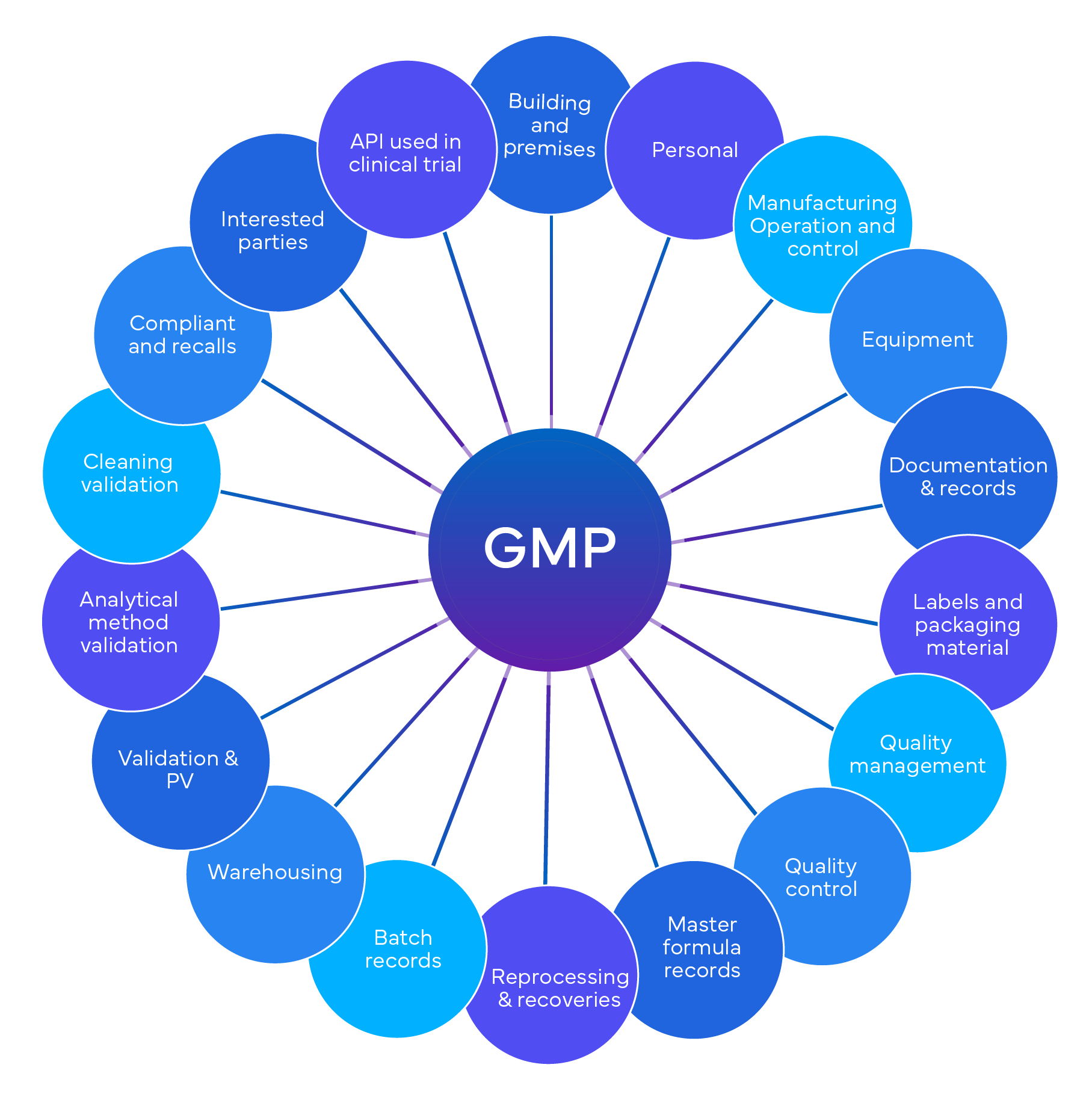
No sector farmacêutico, os processos de conformidade, auditoria e validação são essenciais, salvaguardando a adesão às normas regulamentares, a integridade dos dados e a produção de produtos seguros e eficazes. A conformidade implica o alinhamento das operações com os regulamentos da indústria e as políticas internas. As auditorias, análises sistemáticas, verificam a conformidade, identificam áreas de melhoria e reduzem os riscos. A validação garante que os sistemas, processos e equipamentos cumprem consistentemente os requisitos predefinidos.
As empresas procuram orientação especializada para navegar sem problemas. Os líderes da indústria gerem habilmente estes processos, assegurando padrões globais sem comprometer a eficácia ou segurança dos produtos. À medida que o sector farmacêutico evolui, as abordagens estratégicas de conformidade, auditoria e validação tornam-se fundamentais para o sucesso sustentado. Ao manterem estes processos, as empresas cumprem as referências regulamentares e promovem uma cultura de excelência e inovação numa indústria dinâmica e exigente.
Colabore com um parceiro de confiança para obter orientação estratégica e soluções personalizadas que permitam às suas operações farmacêuticas prosperar num cenário regulamentar dinâmico.

Qual é a importância da Conformidade, Auditoria e Validação na indústria farmacêutica?
A conformidade, a auditoria e a validação são componentes críticos na indústria farmacêutica, garantindo que os produtos são seguros, eficazes e produzidos de acordo com as normas regulamentares.
- Garante a segurança e a eficácia do produto: A conformidade com os regulamentos garante que os produtos farmacêuticos cumprem normas rigorosas de segurança e eficácia antes de chegarem ao mercado. Isto envolve testes rigorosos e processos de validação para confirmar que os produtos funcionam como pretendido e não representam riscos para os doentes.
- Mantém a adesão à regulamentação: As auditorias e validações regulares ajudam as empresas a aderir a regulamentos complexos e em evolução definidos pelas autoridades de saúde. Isto inclui a conformidade com as Boas Práticas de Fabrico (BPF), Boas Práticas Clínicas (BPC) e outras normas da indústria, reduzindo o risco de sanções regulamentares e recolhas de produtos.
- Melhora a garantia de qualidade: Os processos de validação, incluindo as validações de equipamentos e sistemas, asseguram que os processos de fabrico e de ensaio produzem consistentemente produtos de elevada qualidade. As auditorias verificam se estes processos são seguidos corretamente, conduzindo a uma melhor qualidade e fiabilidade dos produtos.
- Apoia o acesso ao mercado e a reputação: As práticas eficazes de conformidade e validação apoiam o acesso ao mercado, demonstrando a adesão aos requisitos regulamentares. Isto melhora a reputação e a credibilidade da empresa, criando confiança junto dos profissionais de saúde, dos doentes e das entidades reguladoras.
- Facilita a melhoria contínua: As auditorias fornecem informações sobre a eficiência dos processos e as áreas a melhorar, conduzindo a um melhor controlo da qualidade e a práticas operacionais. Esta avaliação e ajustamento contínuos ajudam a manter padrões elevados e a adaptar-se às mudanças na regulamentação e às melhores práticas da indústria.
Principais desafios no domínio da conformidade, auditoria e validação
O espaço de Conformidade, Auditoria e Validação enfrenta vários desafios importantes que podem afetar a capacidade das empresas farmacêuticas para cumprir os requisitos regulamentares e manter elevados padrões de qualidade e segurança:
| Desafio | Descrição |
|---|---|
| Conformidade regulamentar | As empresas farmacêuticas têm de aderir a regulamentos rigorosos de agências como a FDA e a EMA, que exigem documentação rigorosa e medidas de controlo de qualidade. O incumprimento pode levar a sanções graves, incluindo coimas e recolhas de produtos. |
| Controlo de acesso e segurança | É fundamental garantir que apenas o pessoal autorizado possa aceder a áreas e informações sensíveis. Isto implica a implementação de sistemas avançados de controlo de acesso e a manutenção da cibersegurança contra ameaças, o que pode ser complexo e dispendioso. |
| Validação do sistema informático (CSV) | A validação dos sistemas informáticos utilizados em ambientes GxP é essencial, mas muitas vezes onerosa e mal definida. O processo exige tempo e recursos significativos, especialmente quando uma abordagem normalizada é aplicada indiscriminadamente. |
| Formação e sensibilização dos trabalhadores | São necessários programas de formação contínua para garantir que os funcionários compreendem os protocolos de conformidade e a sua importância. Uma formação inadequada pode levar à não conformidade e a erros nos processos. |
| Documentação e manutenção de registos | A manutenção de uma documentação exacta e completa é vital para a conformidade. A documentação inadequada é um problema comum que pode levar a observações e falhas regulamentares durante as auditorias. |
| Integridade dos dados | Garantir a integridade e a exatidão dos dados é crucial, especialmente na gestão de grandes volumes de informação. Os desafios incluem o tratamento manual dos dados e a necessidade de sistemas sólidos de gestão de dados. |
| Gestão de fornecedores | A dependência de fornecedores terceiros de software e serviços exige uma validação exaustiva e verificações de conformidade. Gerir estas relações e garantir que cumprem as normas regulamentares pode ser um desafio. |
| Complexidade tecnológica | A crescente complexidade das tecnologias, incluindo a IA e os sistemas cloud-based , apresenta novos desafios de validação e exige uma adaptação contínua a cenários regulamentares em evolução. |
| Controlo de qualidade inadequado | Muitas empresas farmacêuticas debatem-se com a manutenção de padrões de alta qualidade em todos os processos, o que pode levar a contaminação, contaminação cruzada e outros problemas de qualidade. |
| Melhoria e controlo contínuos | As auditorias e inspecções regulares são essenciais para identificar os pontos fracos dos sistemas de conformidade. No entanto, muitas organizações não conseguem implementar medidas proactivas de melhoria contínua |
- Regulamentos em evolução: Acompanhar a rápida mudança de regulamentos e diretrizes em diferentes regiões pode ser um desafio. As empresas farmacêuticas têm de atualizar continuamente as suas práticas de conformidade para aderir a normas regulamentares novas ou revistas, o que pode exigir recursos e ajustes significativos.
- Complexidade das normas globais: Navegar pelos diversos e complexos requisitos regulamentares de diferentes países e regiões aumenta o desafio. Cada jurisdição pode ter o seu próprio conjunto de regras e normas, o que dificulta a obtenção de uma conformidade consistente nos mercados globais.
- Integridade e segurança dos dados: É fundamental garantir a integridade e a segurança dos dados ao longo dos processos de conformidade, auditoria e validação. As empresas devem implementar sistemas e controlos robustos para se protegerem contra violações de dados, adulterações ou imprecisões, que podem ter consequências graves para a aprovação de produtos e a segurança dos doentes.
- Restrições de recursos: A limitação de recursos, incluindo tempo, pessoal e orçamento, pode prejudicar a eficácia das actividades de conformidade e auditoria. As empresas lutam frequentemente para equilibrar as exigências da manutenção da conformidade com a necessidade de afetar recursos a outras funções críticas da empresa.
- Gerir a documentação e a manutenção de registos: A documentação e a manutenção de registos adequados são essenciais para demonstrar a conformidade e realizar auditorias eficazes. No entanto, gerir grandes quantidades de documentação, garantir a sua exatidão e manter a acessibilidade pode ser um desafio, especialmente num ambiente altamente regulamentado.
- Integração de novas tecnologias: A incorporação de tecnologias inovadoras nos processos de conformidade e validação existentes pode ser complexa. Embora tecnologias como a automação e a AI (Artificial Intelligence) ofereçam benefícios significativos, a sua integração deve ser cuidadosamente gerida para garantir que cumprem os requisitos regulamentares e não introduzem novos riscos.
- Formação e competência: É crucial garantir que o pessoal seja adequadamente treinado e competente nos processos de conformidade, auditoria e validação. São necessários programas de formação contínua para manter o pessoal atualizado sobre as alterações regulamentares e as melhores práticas, o que pode exigir muitos recursos.
- Abordagem das constatações de auditoria: Abordar e corrigir eficazmente as questões identificadas durante as auditorias pode ser um desafio. As empresas devem implementar prontamente acções corretivas e preventivas, assegurando simultaneamente que essas acções não perturbam as operações em curso nem afectam a qualidade dos produtos.
- Equilíbrio entre conformidade e inovação: Encontrar um equilíbrio entre o cumprimento de regulamentos rigorosos e a procura de inovação pode ser difícil. As empresas têm de navegar no panorama regulamentar, continuando a desenvolver e a introduzir novos produtos e tecnologias.
- Garantir a consistência entre as operações: Manter a consistência nas práticas de conformidade e nos processos de validação em diferentes departamentos, instalações e fases do ciclo de vida do produto é essencial, mas desafiante. A variabilidade nas práticas pode levar à não conformidade e a problemas de qualidade.
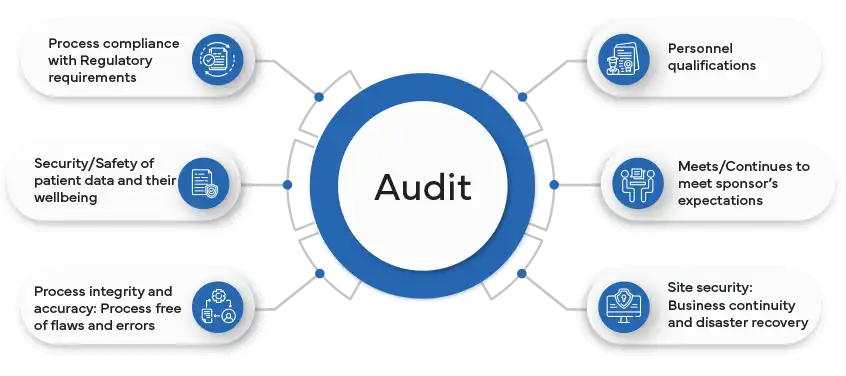
O que são auditorias GxP?
O que é uma auditoria de conformidade independente GxP e who a efectua?
Uma auditoria de conformidade GxP é um processo desenvolvido para garantir que as empresas aderem a normas predefinidas de qualidade, segurança e conformidade regulamentar. Pode abranger vários aspectos dos produtos e processos farmacêuticos, tais como as Boas Práticas de LaboratórioGLP), as Boas Práticas Clínicas (BPC), as Boas Práticas de Fabrico (BPF) e as Boas Práticas de Farmacovigilância (BPF).
A auditoria avalia o nível de conformidade com as leis, os regulamentos, as diretrizes e os Standard Operating Procedures (SOPs) aplicáveis e identifica as lacunas, os riscos e as oportunidades de melhoria. A auditoria também fornece recomendações e medidas corretivas para abordar as conclusões e melhorar os sistemas de qualidade.
As vantagens de uma auditoria GxP incluem:
- Fornecer uma avaliação imparcial e objetiva dos sistemas de qualidade e do nível de conformidade.
- Reforçar a confiança das entidades reguladoras, clientes, fornecedores e outras partes interessadas.
- Reduzir a probabilidade e a gravidade das inspecções, observações e sanções regulamentares.
- Melhorar a qualidade, a segurança e a eficácia dos produtos e dos processos.
- Aumentar a eficiência e a eficácia das operações e reduzir os custos e os erros.
- Apoiar a melhoria contínua e a inovação dos produtos e processos.
Uma auditoria GxP é realizada por um auditor qualificado e experiente ou por uma equipa de auditores com conhecimentos, competências e credenciais relevantes na indústria farmacêutica e na área específica da GxP. O auditor ou a equipa de auditoria deve ser independente da empresa que está a ser auditada e seguir os padrões profissionais e princípios éticos de auditoria. Também devem usar ferramentas e métodos adequados para realizar a auditoria, como listas de verificação, entrevistas, observações, revisões de documentos, amostragens, testes, etc. Freyr end-to-end em auditorias GxP. Como líderes do setor, os nossos especialistas tornarão a sua jornada de conformidade perfeita.
Quadro regulamentar para auditorias GxP
A conformidade GxP é um conjunto de regulamentos que regem vários sectores regulamentados, incluindo produtos farmacêuticos, dispositivos médicos, alimentos, bebidas e biotecnologia. O principal objetivo da conformidade GxP é manter a qualidade do produto e garantir a segurança pública. Aqui estão alguns pontos-chave:
- Visão geral da conformidade GxP:
- As BPx englobam várias normas, incluindo as Boas Práticas de LaboratórioGLP), as Boas Práticas Clínicas (BPC), as Boas Práticas de Fabrico (BPF) e as Boas Práticas de Farmacovigilância (BPF).
- Estas normas garantem que os produtos são cuidadosamente testados, fabricados e manuseados ao longo do seu ciclo de vida.
- Conferência Internacional sobre HarmonizaçãoICH):
- A ICH fornece diretrizes para a conformidade GxP.
- O Guia de Boas Práticas de FabricoICH Q7A aborda especificamente as práticas de fabrico de ingredientes farmacêuticos activosAPIs).
- Inspecções FDA:
- A U.S. Food and Drug Administration (FDA) realiza inspecções para avaliar a conformidade com os regulamentos GxP.
- Estas inspecções avaliam a adesão a regulamentos e diretrizes específicos FDA .
- Inspecções Health Canada:
- Health Canada, a autoridade reguladora do Canadá, também efectua inspecções para garantir a conformidade com as BPx.
- Estas inspecções incidem sobre vários aspectos, incluindo o fabrico, o controlo de qualidade e a distribuição.
- Critérios de avaliação para auditorias GxP:
A conformidade nas auditorias independentes GxP é normalmente avaliada em função de uma série de critérios, que podem incluir
- Requisitos regulamentares: Conformidade com regulamentos, diretrizes e leis específicos aplicáveis à área GxP (por exemplo, regulamentos FDA , diretrizes ICH ou normas ISO).
- Sistemas de qualidade: Avaliação dos sistemas de gestão da qualidade, práticas de documentação e manutenção de registos.
- Validação de processos: Verificação de que os processos são validados e cumprem os critérios predefinidos.
- Formação e competência: Avaliação da formação e das qualificações do pessoal.
- Gestão de riscos: Identificação e atenuação dos riscos relacionados com a qualidade e segurança dos produtos.
Saiba como um especialista em regulamentação comprovado pode ajudá-lo a criar a estrutura ideal de auditoria GxP adequada às suas necessidades e ajudá-lo a manter-se em conformidade com os regulamentos globais.
Benefícios da realização de auditorias de conformidade GxP
As auditorias GxP têm inúmeras vantagens para qualquer organização. Em primeiro lugar, fornecem uma avaliação imparcial e independente do risco e da conformidade dentro da organização, permitindo que as empresas identifiquem áreas de não conformidade ou de risco potencial que possam ser negligenciadas nas auditorias internas. Estas auditorias são essenciais para garantir que as empresas aderem a determinados padrões de qualidade, segurança e conformidade regulamentar.
| Aspeto | Descrição |
|---|---|
| Análise exaustiva | Avaliação exaustiva por um terceiro qualificado para identificar áreas não conformes. |
| Normas regulamentares | Cumprimento das normas GxP (boas práticas) como GMP, GCP e GLP. |
| Âmbito de aplicação personalizado | Âmbito de auditoria personalizado com base em produtos e processos específicos. |
| Auditores qualificados | Auditores experientes e familiarizados com a regulamentação. |
| Quadro regulamentar | Segue as diretrizes ICH Q7A, FDA e Health Canada . |
| Benefícios | Avaliações imparciais, prevenção de riscos, manutenção da qualidade e escalabilidade. |
Seguem-se alguns pontos-chave sobre as auditorias de conformidade GxP:
- Revisão abrangente: As auditorias GxP envolvem um processo de revisão exaustivo conduzido por uma organização ou consultor terceiro qualificado. O objetivo é identificar quaisquer áreas de não-conformidade na organização e fornecer recomendações para melhoria.
- Normas regulamentares: Os regulamentos revistos durante estas auditorias são definidos por normas GxP (boas práticas), tais como Boas Práticas de Fabrico (BPF), Boas Práticas Clínicas (BPC) e Boas Práticas de LaboratórioGLP). Estas normas garantem que os produtos, serviços e processos cumprem consistentemente os requisitos regulamentares relevantes.
- Âmbito adaptado: O âmbito de uma auditoria independente é personalizado para os produtos e processos específicos da organização. Pode incluir gestão de pessoal, gestão de instalações, manutenção de registos, garantia e controlo de qualidade, conceção de produtos e processos e operações técnicas.
- Auditores qualificados: A auditoria deve ser efectuada por um auditor qualificado e experiente who esteja familiarizado com os regulamentos aplicáveis e possua as competências necessárias para avaliar eficazmente os procedimentos e processos da organização.
- Quadro regulamentar: As auditorias GxP seguem enquadramentos como o Guia de Boas Práticas de Fabrico Q7A da Conferência Internacional sobre HarmonizaçãoICH), as inspecções FDA e as inspecções Health Canada . Estas estruturas fornecem orientações sobre os requisitos básicos para a produção, garantia de qualidade, distribuição e outras actividades críticas relacionadas com o fabrico seguro de produtos.
- Vantagens: As auditorias GxP oferecem avaliações imparciais, ajudam a evitar problemas de não conformidade, mantêm os padrões de qualidade e garantem a responsabilidade. A subcontratação destas auditorias permite o acesso a conhecimentos especializados, objetividade, eficiência de custos e escalabilidade, ao mesmo tempo que permite às empresas concentrarem-se nas suas competências principais.
Se está à procura de soluções de conformidade GxP, considere Freyr. Somos especializados em conformidade regulamentar, garantia de qualidade e segurança no sector das ciências da vida. Com a nossa experiência, pode garantir o cumprimento das normas GxP, otimizar processos e manter produtos e serviços de alta qualidade.
Dicas para preparar a sua organização para uma auditoria
Preparar a sua organização para uma auditoria é um processo estratégico que envolve um planeamento meticuloso e uma abordagem proactiva. Em primeiro lugar, certifique-se de que todos os registos, documentação e ficheiros relevantes estão organizados e prontamente acessíveis. Um sistema de arquivo bem organizado facilita um processo de auditoria mais suave e reflecte positivamente o profissionalismo da sua organização.
Em segundo lugar, efetuar uma pré-auditoria interna para identificar potenciais áreas de preocupação. Esta autoavaliação permite-lhe resolver quaisquer questões ou discrepâncias antes da auditoria externa. Ao resolver os problemas de forma proactiva, demonstra o seu empenho na conformidade e transparência.
Em terceiro lugar, comunicar e colaborar eficazmente com a equipa de auditoria. Fornecer as informações necessárias, o acesso ao pessoal relevante e um ambiente de trabalho propício. Uma comunicação clara ajuda a criar uma relação positiva com os auditores, promovendo uma atmosfera de colaboração durante o processo de auditoria.
Por último, certifique-se de que a sua equipa está bem formada e consciente do processo de auditoria. Eduque os funcionários sobre as suas funções, responsabilidades e a importância da conformidade. Ao incutir uma cultura de preparação e cooperação, a sua organização pode passar por auditorias com confiança e profissionalismo.
Compreender as auditorias remotas
O que é uma auditoria remota na indústria farmacêutica e em que é que difere das tradicionais auditorias no local?
Uma auditoria remota na indústria farmacêutica é uma avaliação abrangente dos processos, instalações e sistemas de uma empresa, efectuada por autoridades reguladoras ou auditores sem uma presença física no local. Esta auditoria é facilitada por ferramentas de comunicação digital, software de colaboração e acesso remoto a documentos e sistemas relevantes. O seu objetivo é garantir a conformidade com as normas regulamentares, avaliar os sistemas de gestão da qualidade e verificar a adesão às Boas Práticas de Fabrico (BPF), às Boas Práticas Clínicas (BPC) ou a outros regulamentos aplicáveis.
A diferença entre as auditorias remotas e as auditorias tradicionais no local é a ausência de presença física durante uma auditoria remota. Em vez de visitarem as instalações da empresa, os auditores recorrem a interações virtuais, documentação eletrónica e acesso remoto aos sistemas. Esta abordagem oferece flexibilidade e eficiência, permitindo que as auditorias se realizem independentemente das distâncias geográficas e das restrições de deslocação. No entanto, desafios como a observação direta limitada das instalações e potenciais preocupações com a cibersegurança têm de ser abordados para garantir a eficácia das auditorias à distância.
Apesar das diferenças, os objectivos das auditorias remotas e tradicionais permanecem os mesmos - verificar a conformidade, identificar áreas de melhoria e garantir a qualidade e segurança dos produtos farmacêuticos. A escolha entre auditorias remotas e no local depende de factores como a natureza da auditoria, os requisitos regulamentares e as capacidades da empresa para facilitar uma avaliação exaustiva através de meios remotos.
Freyr aproveita uma década de experiência para fornecer soluções regulamentares sem paralelo, garantindo a conformidade e o sucesso no dinâmico panorama farmacêutico.
Explore a excelência regulamentar us - o seu parceiro estratégico para o sucesso da conformidade na indústria farmacêutica em constante evolução. Ligue-se a us para navegar sem problemas nas complexidades regulamentares.
Que desafios podem surgir durante as auditorias remotas e como são abordados para garantir avaliações exaustivas?
Durante as auditorias remotas, podem surgir vários desafios, mas as organizações podem tomar medidas para os resolver e garantir avaliações completas. Aqui estão alguns dos principais desafios e as suas potenciais soluções:
- Criar relações importantes com as partes interessadas na auditoria:
- Desafio: O trabalho remoto pode dificultar o desenvolvimento de relações fortes com os intervenientes na auditoria.
- Solução: Reuniões virtuais regulares, comunicação aberta e envolvimento ativo podem ajudar a criar e manter relações. Utilize chamadas de vídeo para estabelecer uma ligação pessoal.
- Investir em tecnologia para o trabalho virtual:
- Desafio: As auditorias remotas dependem muito da tecnologia, e ferramentas inadequadas podem prejudicar a eficiência.
- Solução: Investir em software robusto de gestão de auditorias, plataformas de comunicação seguras e ferramentas de colaboração. Assegurar que os auditores possuem o hardware e o software necessários.
- Desenvolver os colaboradores e promover uma cultura positiva à distância:
- Desafio: O trabalho à distância pode levar ao isolamento e dificultar o crescimento profissional.
- Solução: Fornecer formação virtual, orientação e oportunidades para o desenvolvimento de competências. Promover uma cultura positiva através de actividades de formação de equipas, reconhecimento e controlos regulares.
- Cultivar uma mentalidade intencional e adaptativa:
- Desafio: Os auditores remotos têm de se adaptar às circunstâncias em mudança e manter-se concentrados.
- Solução: Incentivar a flexibilidade, a adaptabilidade e uma mentalidade de crescimento. Formar os auditores para lidarem com situações inesperadas e ajustarem a sua abordagem conforme necessário.
Freyr é um parceiro de confiança em soluções de segurança e conformidade regulamentar para a indústria das ciências da vida. Com uma profunda experiência no domínio, tecnologia inovadora e uma presença global, Freyr capacita as organizações a navegarem sem problemas em cenários regulamentares complexos. Explore os nossos serviços e us hoje mesmo para elevar a sua jornada de conformidade.
Como é que Freyr está mais bem colocada para o ajudar nas suas auditorias remotas?
Freyr, com a sua experiência de décadas, destaca-se por facilitar auditorias remotas sem falhas para a indústria farmacêutica. Aproveitando tecnologias avançadas e um profundo conhecimento dos requisitos regulamentares, Freyr garante um processo de auditoria completo e eficiente, abordando desafios como a presença física limitada e preocupações com a cibersegurança.
A nossa equipa dedicada de especialistas em Regulamentação é adepta da utilização de soluções digitais inovadoras, garantindo uma avaliação virtual abrangente dos seus processos, instalações e documentação. O nosso histórico comprovado de realizações em auditorias remotas reflecte o nosso compromisso em fornecer soluções regulamentares fiáveis e eficazes, adaptadas às necessidades em evolução do panorama farmacêutico. Com a Freyr, ganha um parceiro de confiança who compreende as complexidades das auditorias remotas e traz uma abordagem proactiva e colaborativa para melhorar a sua jornada de conformidade.
O que é a Validação do Sistema Informático (CSV) e porque é que é crucial na indústria farmacêutica?
A Validação do Sistema Informático (CSV) é um processo crítico na indústria farmacêutica que assegura a integridade, fiabilidade e conformidade dos sistemas informáticos utilizados para vários fins. Vamos aprofundar os pormenores:
- Definição e objetivo:
- O CSV é o processo documentado que garante que um sistema informático produzirá informações ou dados que satisfazem requisitos predefinidos.
- O seu principal objetivo é validar e verificar se os sistemas informáticos funcionam de forma consistente como previsto, mantendo a exatidão, fiabilidade e segurança dos dados.
- Importância na indústria farmacêutica:
- Conformidade regulamentar: A indústria farmacêutica opera sob regulamentos rigorosos (como as Boas Práticas de Fabrico ou BPF) para garantir a qualidade, segurança e eficácia dos produtos.
- Integridade dos dados: Dados exactos e fiáveis são cruciais para o desenvolvimento de medicamentos, ensaios clínicos, fabrico e distribuição.
- Mitigação de riscos: O CSV ajuda a identificar e mitigar os riscos associados aos sistemas informáticos, evitando erros, perda de dados e não-conformidade.
- Segurança dos doentes: Os sistemas corretamente validados contribuem para a segurança dos doentes, garantindo uma qualidade consistente e o cumprimento das normas.
- Aspectos fundamentais do CSV:
- Definição de requisitos: Definir claramente os requisitos do sistema, as funcionalidades e as expectativas do utilizador.
- Conceção e configuração: Desenvolver e configurar o sistema de acordo com as especificações.
- Testes e qualificação: Testes rigorosos (incluindo testes unitários, testes de integração e testes de aceitação do utilizador) para verificar o desempenho do sistema.
- Documentação: Manter uma documentação completa durante todo o ciclo de vida do sistema.
- Controlo de alterações: Gerir as alterações ao sistema, garantindo que não comprometem a sua integridade.
- Desafios abordados pelo CSV:
- Integridade dos dados: Impedir o acesso não autorizado, a corrupção ou a manipulação de dados.
- Segurança do sistema: Proteger contra ameaças cibernéticas e modificações não autorizadas.
- Registo de auditoria: Manter uma pista de dados eletrónica indelével para auditorias regulamentares.
- Manutenção da validação: Rever e atualizar regularmente a validação para se adaptar às alterações do sistema.
Em que é que a CSV difere da CSA (Computer System Assurance)?
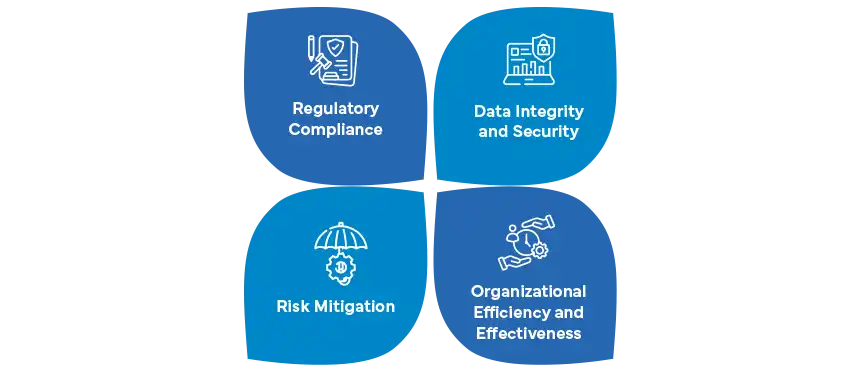
A Validação de Sistemas Informáticos (CSV) e a Garantia de Sistemas Informáticos (CSA) representam abordagens distintas para garantir a integridade e a conformidade dos sistemas informáticos na indústria farmacêutica. A CSV, uma prática de longa data, centra-se principalmente na fase de validação do ciclo de vida de um sistema, garantindo que os sistemas de software cumprem os requisitos regulamentares através de protocolos predefinidos. Por outro lado, a CSA adopta uma abordagem mais abrangente e dinâmica, cobrindo todo o ciclo de vida de um sistema computorizado, desde o desenvolvimento e implementação até à utilização operacional e eventual retirada.
A CSV aborda a necessidade de processos de validação rigorosos, enfatizando abordagens baseadas no risco para identificar e mitigar potenciais problemas. No entanto, o panorama farmacêutico está a evoluir, o que levou ao aparecimento da CSA como uma estratégia mais abrangente. A CSA estende o seu foco para além da validação, adaptando metodologias ágeis e incorporando a monitorização contínua ao longo do ciclo de vida de um sistema. Esta perspetiva holística permite às organizações gerir proactivamente os riscos, especialmente em termos de cibersegurança e integridade dos dados, alinhando-se com a ênfase crescente da indústria na tecnologia e na segurança dos dados.
A adaptabilidade da CSA é valiosa num ambiente regulamentar em rápida mudança. Enquanto a CSV adere às práticas de validação tradicionais, a CSA alinha-se com as expectativas em evolução das autoridades reguladoras. Vai além dos esforços de revalidação periódica, incorporando monitorização contínua, análise de dados em tempo real e estratégias proactivas de gestão de riscos para garantir a conformidade contínua e o desempenho ideal. À medida que a indústria farmacêutica abraça a transformação digital, a compreensão das nuances entre CSV e CSA torna-se imperativa para as empresas que pretendem manter-se na vanguarda da conformidade regulamentar e da integridade do sistema.
Neste contexto, Freyr, com a sua vasta experiência e conhecimentos especializados, está bem equipada para orientar as empresas farmacêuticas através dos meandros do CSV e do CSA, oferecendo soluções personalizadas para satisfazer as exigências em evolução da conformidade regulamentar e dos avanços tecnológicos.
Quais são os componentes de um programa CSA?
A Garantia de Software Informático (CSA) é uma abordagem moderna que aumenta a fiabilidade, a segurança e a conformidade dos sistemas informáticos. Vamos explorar os seus componentes e benefícios a longo prazo:
- Abordagem baseada no risco:
- Componente: A CSA centra-se na avaliação e gestão dos riscos.
- Importância: A identificação de áreas críticas ajuda a afetar eficazmente os esforços de validação.
- Testes sem guião:
- Componente: A CSA inclui testes sem guião para além dos casos de teste com guião tradicionais.
- Importância: Os testes sem guião imitam cenários do mundo real, descobrindo problemas ocultos.
- Monitorização contínua do desempenho:
- Componente: A CSA envolve o controlo permanente do desempenho do sistema.
- Importância: A deteção precoce de anomalias evita falhas no sistema e problemas de integridade dos dados.
- Supervisão de dados:
- Componente: A CSA dá ênfase à qualidade e integridade dos dados.
- Importância: Assegura dados exactos para a tomada de decisões e a conformidade.
- Actividades de validação externa:
- Componente: A CSA colabora com os fornecedores de software para validação externa.
- Importância: A validação independente aumenta a confiança e reduz o enviesamento.
- Transição de CSV para CSA:
- Etapas iniciais:
- Compreender os princípios da CSA.
- Avaliar o risco dos sistemas existentes.
- Dar prioridade às funcionalidades críticas.
- Benefícios:
- Redução do volume de trabalho de validação.
- Resposta ágil às mudanças.
- Maior fiabilidade do sistema.
- Etapas iniciais:
- Fiabilidade do sistema a longo prazo:
- A CSA garante:
- Adaptabilidade: Os sistemas evoluem sem comprometer a fiabilidade.
- Segurança: Proteção contra ciberameaças.
- Conformidade: Alinhamento contínuo com os regulamentos.
- Qualidade: Dados consistentes e qualidade do produto.
- A CSA garante:
Como é que a CSA contribui para a integridade dos dados na indústria farmacêutica?
A CSA defende a integridade dos dados na indústria farmacêutica, garantindo a exatidão, a consistência e a fiabilidade dos dados ao longo do ciclo de vida de um sistema. Ao contrário das abordagens tradicionais, a CSA adopta uma estratégia holística que se estende para além da validação, tratando ativamente de potenciais desafios e discrepâncias que possam surgir ao longo do tempo.
Uma contribuição da CSA para a integridade dos dados reside nas suas capacidades de monitorização contínua. Em vez de se basear apenas em esforços de validação periódicos, a CSA envolve a análise de dados em tempo real e medidas proactivas de gestão de riscos. Esta abordagem permite que as organizações detectem e resolvam potenciais discrepâncias de dados, evitando que as imprecisões se acumulem ao longo do tempo. A ênfase da CSA num modelo de ciclo de vida dinâmico e adaptável garante que a integridade dos dados permanece um foco constante, alinhando-se com as expectativas regulamentares.
Para evitar discrepâncias de dados ao longo do tempo, a CSA incorpora várias medidas estratégicas. Em primeiro lugar, utiliza processos robustos de controlo de alterações, documentando meticulosamente quaisquer modificações nos sistemas ou processos informáticos que possam afetar a integridade dos dados. São realizadas auditorias e avaliações regulares do sistema para identificar e retificar potenciais problemas antes que estes se agravem. Além disso, a CSA realça a importância dos programas de formação e sensibilização dos utilizadores para garantir que o pessoal compreende a importância de manter a integridade dos dados e adere às melhores práticas.
Em conclusão, a abordagem proactiva e abrangente da CSA à integridade dos dados distingue-a como uma solução estratégica na indústria farmacêutica. Ao incorporar a monitorização contínua, a gestão de riscos e medidas rigorosas de controlo de alterações, a CSA mantém a integridade dos dados e garante que as empresas farmacêuticas estão bem preparadas para navegar no cenário em evolução das expectativas regulamentares. À medida que as organizações se esforçam por manter os mais elevados padrões de integridade dos dados, a CSA surge como um aliado fundamental no seu percurso, alinhando-se com as tendências da indústria e os avanços regulamentares.
Para as organizações que procuram orientação sobre a implementação de estratégias de CSA eficazes, Freyr é um parceiro fiável que oferece soluções personalizadas para enfrentar os desafios únicos do panorama farmacêutico.
Que papel desempenha a conformidade regulamentar na CSA?
A conformidade regulamentar é uma pedra angular da CSA, garantindo que as empresas farmacêuticas aderem às normas e diretrizes em evolução ao longo do ciclo de vida de um sistema. Ao contrário do foco tradicional da Validação do Sistema Informático (CSV), a CSA enfatiza a conformidade contínua e a adaptabilidade a cenários regulamentares em mudança. À medida que as empresas fazem a transição da CSV para a CSA, manter-se atualizado sobre os regulamentos em evolução torna-se fundamental.
No contexto da CSA, a conformidade regulamentar envolve o alinhamento dos sistemas informáticos com os requisitos regulamentares globais e locais, desde o desenvolvimento até à utilização operacional e eventual retirada. A CSA enfatiza a conformidade contínua em vez da validação periódica, promovendo uma abordagem proactiva para abordar prontamente potenciais alterações regulamentares. Este alinhamento estratégico assegura que as empresas farmacêuticas estão bem preparadas para cumprir as expectativas regulamentares, salvaguardando a integridade dos dados, a segurança dos doentes e a fiabilidade geral do sistema.

O envolvimento regular com as autoridades reguladoras, a participação em fóruns do setor e a assinatura de publicações regulatórias fornecem informações valiosas sobre a evolução das normas. Aproveitar a experiência de consultores regulatórios e investir na formação contínua do pessoal envolvido nos processos da CSA aumenta ainda mais a consciência regulatória. A colaboração com parceiros regulatórios, como Freyr Solutions, oferece uma abordagem proativa, garantindo acesso a informações regulatórias atualizadas e soluções personalizadas para navegar sem problemas pela transição.
A conformidade regulamentar na CSA é um compromisso dinâmico e contínuo que se alinha com a mudança da indústria para a adaptabilidade e a melhoria contínua. Manter-se informado, pró-ativo e estabelecer parcerias com especialistas em regulamentação são cruciais para as empresas que fazem a transição do CSV para o CSA, facilitando uma evolução suave e em conformidade com o panorama farmacêutico em constante mudança.
Como parceiro de confiança na área da regulamentação, Freyr fornece o apoio e a experiência necessários para orientar as empresas durante esta transição, garantindo a excelência e a conformidade regulamentar na era da CSA.
Como é que um parceiro estratégico de conformidade regulamentar pode ajudar?
Um parceiro estratégico de conformidade regulamentar desempenha um papel fundamental para garantir que as empresas farmacêuticas cumprem os requisitos regulamentares e mantêm elevados padrões de qualidade. Veja como eles podem ajudar:
- Orientação especializada: Um parceiro estratégico fornece aconselhamento especializado na navegação de regulamentos complexos e em evolução em diferentes regiões. Oferecem informações sobre as mais recentes alterações regulamentares, ajudando as empresas a ajustar as suas práticas e a manter a conformidade.
- Processos simplificados: Ajudam a simplificar os processos de conformidade, implementando as melhores práticas e fluxos de trabalho eficientes. Isto inclui o desenvolvimento de sistemas robustos para documentação, auditoria e validação, reduzindo os encargos administrativos e melhorando a eficiência geral.
- Mitigação de riscos: Ao identificar potenciais riscos de conformidade e vulnerabilidades, um parceiro estratégico ajuda a mitigar os riscos antes que se tornem problemas. Efectuam auditorias e avaliações exaustivas para garantir que todos os processos estão em conformidade e resolvem quaisquer lacunas de forma proactiva.
- Formação e apoio: Oferecem formação e apoio para garantir que o pessoal está bem informado sobre os requisitos regulamentares e as melhores práticas. Isto ajuda a criar competências internas e assegura que todos os envolvidos em actividades de conformidade estão actualizados em relação às normas actuais.
- Integração de tecnologia: Um parceiro estratégico ajuda na integração de tecnologias inovadoras, como a automatização e a IA, nos processos de conformidade. Garantem que estas tecnologias são implementadas de forma eficaz e de acordo com os requisitos regulamentares, melhorando a integridade dos dados e a eficiência dos processos.
- Documentação e manutenção de registos: Gerem a criação, organização e manutenção de documentação de conformidade crucial. Isto assegura que todos os registos são precisos, completos e prontamente acessíveis para auditorias e inspecções.
- Submissões e aprovações regulamentares: Tratam da preparação e apresentação de documentos e candidaturas regulamentares. Isto inclui assegurar que as submissões cumprem todos os requisitos necessários e gerir as comunicações com as autoridades reguladoras para facilitar aprovações atempadas.
- Acções Corretivas e Preventivas: Um parceiro estratégico apoia o desenvolvimento e a implementação de acções corretivas e preventivas em resposta a conclusões de auditorias ou questões de conformidade. Ajudam a garantir que estas acções são eficazes e não perturbam as operações em curso.
- Estratégia de conformidade global: Desenvolvem e implementam estratégias para alcançar a conformidade global, abordando os diversos requisitos regulamentares dos diferentes mercados. Isto assegura que os produtos cumprem todas as normas necessárias para a distribuição e utilização internacionais.
- Monitorização contínua: Fornecem monitorização e suporte contínuos para manter as empresas informadas sobre quaisquer actualizações ou alterações regulamentares. Esta abordagem proactiva ajuda as empresas a manterem-se em conformidade e a adaptarem-se a novos regulamentos à medida que estes surgem.
Porquê escolher Freyr?
Mais de dez anos de excelência em matéria de conformidade regulamentar.
Todo o espetro de conformidade, auditoria e validação.
Experiência em diversos sectores e regiões geográficas.
Utiliza ferramentas inovadoras para obter resultados exactos.
Profissionais qualificados com um conhecimento profundo do sector.
Gestão bem sucedida de desafios de conformidade complexos.
Perguntas mais frequentes
A conformidade farmacêutica envolve a adesão a leis, regulamentos e diretrizes que regem a indústria farmacêutica. Assegura que as empresas alinham as suas operações com as normas da indústria, salvaguardando assim a segurança e a eficácia dos produtos e mantendo a integridade dos dados.
O objetivo de uma auditoria é avaliar sistematicamente a adesão de uma empresa às normas regulamentares e às políticas internas. As auditorias ajudam a identificar áreas de melhoria, a mitigar riscos e a garantir que os processos são eficazes na produção de produtos farmacêuticos seguros e conformes.
A validação no sector farmacêutico é o processo de confirmação de que os sistemas, processos e equipamentos cumprem consistentemente os requisitos predefinidos. É essencial para garantir a conformidade com as normas regulamentares e para manter a qualidade e a segurança dos produtos farmacêuticos ao longo do seu ciclo de vida.
Estes processos são essenciais para garantir a segurança e a eficácia dos produtos, manter a adesão à regulamentação, melhorar a garantia de qualidade, apoiar o acesso ao mercado e facilitar a melhoria contínua. Ajudam as empresas a cumprir normas rigorosas e a criar confiança junto das partes interessadas.
Os desafios incluem a navegação em regulamentos em evolução, a garantia da integridade dos dados, a gestão de restrições de recursos e a manutenção de documentação adequada. Além disso, a integração de tecnologias inovadoras e a garantia da competência do pessoal podem complicar os esforços de conformidade.
As auditorias GxP são avaliações efectuadas para garantir a adesão às normas de Boas Práticas (GxP), que incluem Boas Práticas de Fabrico (GMP), Boas Práticas Clínicas (GCP) e Boas Práticas de LaboratórioGLP). Estas auditorias ajudam a identificar lacunas de conformidade e a melhorar os sistemas de qualidade.
Uma auditoria de conformidade independente GxP é uma avaliação objetiva da adesão de uma empresa às normas de qualidade e regulamentares. Realizada por auditores qualificados, identifica os riscos e as áreas a melhorar, reforçando a conformidade e a segurança dos produtos.
As auditorias GxP fornecem avaliações imparciais, melhoram a conformidade regulamentar e identificam áreas para melhoria operacional. Ajudam a manter padrões de alta qualidade e a criar confiança junto de reguladores e clientes.
O que é a Validação do Sistema Informático (CSV) e porque é que é crucial na indústria farmacêutica?
A CSV assegura que os sistemas computorizados utilizados nos produtos farmacêuticos produzem consistentemente dados fiáveis e cumprem os requisitos regulamentares. É vital para manter a integridade dos dados, mitigar riscos e garantir a segurança dos pacientes durante todo o ciclo de vida do produto.
A CSV centra-se na validação de que um sistema cumpre os requisitos regulamentares e funciona como previsto, enquanto a CSA engloba uma abordagem mais ampla que inclui a garantia contínua do desempenho e da conformidade do sistema ao longo do seu ciclo de vida.










