Perguntas mais frequentes
Assuntos Regulamentares RA) na indústria farmacêutica envolvem garantir a qualidade, segurança e eficácia dos medicamentos ao longo do seu ciclo de vida. RA lidam com os complexos requisitos das autoridades sanitárias globais, mantendo a conformidade desde a descoberta do medicamento até à sua comercialização. Eles atuam como um elo de comunicação entre as empresas farmacêuticas e as autoridades regulatórias em todo o mundo.
O principal objetivo da regulamentação na indústria farmacêutica é salvaguardar a saúde pública, garantindo que os novos medicamentos são seguros e eficazes antes de chegarem ao mercado. As agências reguladoras aplicam normas rigorosas de teste e avaliação, minimizando os potenciais riscos para a saúde. Esta supervisão regulamentar proporciona confiança nos tratamentos médicos disponíveis para o público.
Assuntos Regulamentares garantem que os produtos farmacêuticos cumpram as normas regulamentares ao longo do seu ciclo de vida. Estão envolvidos na conceção de ensaios clínicos, Autorização de Introdução no Mercado e na gestão pós-aprovação, garantindo a conformidade contínua e facilitando as alterações necessárias aos produtos. A sua experiência ajuda as empresas a colocar no mercado produtos seguros e eficazes de forma eficiente.
A gestão do ciclo de vida dos produtos farmacêuticos envolve manter a viabilidade de um produto desde o desenvolvimento até após a aprovação. Inclui estratégias para o desenvolvimento clínico, Autorização de Introdução no Mercado e conformidade contínua com as normas regulamentares. Uma gestão eficaz do ciclo de vida garante que o produto permaneça seguro e eficaz durante toda a sua presença no mercado.
A regulamentação farmacêutica evoluiu significativamente, desde as listas de medicamentos medievais até os esforços modernos de harmonização internacional. Os principais marcos incluem a Lei de Alimentos e Medicamentos US de 1906 e a formação da Conferência Internacional sobre Harmonização (ICH) em 1990. Esses desenvolvimentos fortaleceram os padrões globais de segurança e eficácia dos medicamentos.
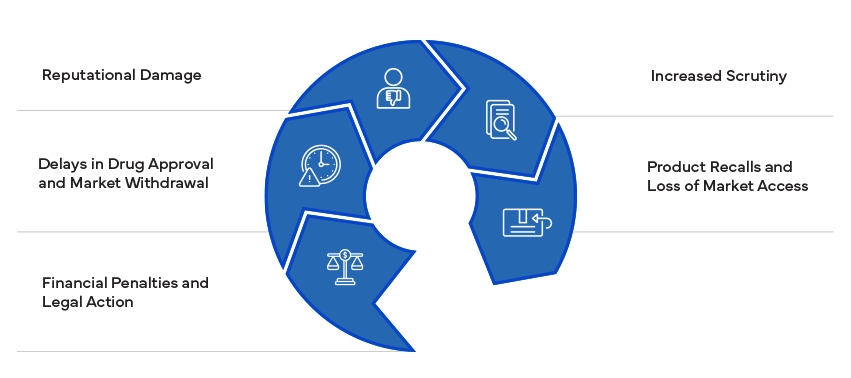
O incumprimento das normas regulamentares pode ter consequências significativas, incluindo coimas, litígios e retirada de produtos. Pode prejudicar a reputação de uma empresa e resultar num maior controlo por parte das autoridades reguladoras. Garantir a conformidade é essencial para evitar estes riscos e manter o acesso ao mercado.
Freyr oferece soluções regulamentares abrangentes, apoiando os clientes desde a fase inicial de desenvolvimento até à comercialização. Os seus serviços incluem a preparação de documentação para as autoridades de saúde, a identificação de desafios regulamentares e o aconselhamento sobre estratégias pós-comercialização. A experiência da Freyr ajuda a acelerar o desenvolvimento de produtos e a disponibilidade no mercado.
A harmonização regulamentar global visa simplificar os processos de desenvolvimento e registo de medicamentos em diferentes países. Minimiza os testes em animais e assegura a saúde pública, alinhando os requisitos regulamentares a nível internacional. Esta harmonização facilita a introdução eficiente de novos tratamentos nos mercados globais.
As agências reguladoras, como a FDA nos Estados Unidos e a EMA na União Europeia, aplicam normas para garantir a segurança e a eficácia dos medicamentos. Supervisionam processos exaustivos de teste e avaliação antes de os medicamentos poderem ser comercializados. Estas agências equilibram a necessidade de novos tratamentos com a minimização de potenciais riscos para a saúde.
A estrutura Global Regulatory intelligence da Freyr fornece informações actualizadas sobre os regulamentos globais e as posições das Autoridades de Saúde. Esta estrutura é integrada em projectos de clientes/clientes para melhorar o sucesso específico do mercado. Apoia o planeamento estratégico e a conformidade regulamentar em várias geografias.