Regulatory Labeling Services globais Regulatory Labeling Services para o sector farmacêutico
Aproveite uma década de experiência com os nossos Regulatory Labeling services, que abrangem autorizações de novos produtos, submissões de Autoridades de Saúde, pós-aprovações, CMC e gestão do ciclo de vida. O nosso enfoque na excelência global e local assegura a criação e atualização estratégicas de documentos de rotulagem essenciais, como IBs, CDS e CCDS, garantindo a conformidade e o sucesso na indústria farmacêutica.
Procurar tópicos
- O que é a rotulagem regulamentar?
- Porque é que a rotulagem regulamentar é importante na indústria farmacêutica?
- O que é o processo de aprovação da rotulagem?
- Quais são os desafios comuns na rotulagem regulamentar?
- Quais são os principais regulamentos que regem a rotulagem farmacêutica?
- Como é que um parceiro de regulamentação pode ajudar a alcançar a conformidade com os requisitos de rotulagem?
- Como é que as empresas podem começar a utilizar os Regulatory Labeling Services?
- Regulatory Labeling Services podem ajudar na monitorização pós-comercialização?
- Porquê escolher Freyr?
- Os nossos serviços
O que é a rotulagem regulamentar?
Última atualização em: agosto de 2024
A rotulagem regulamentar farmacêutica envolve a criação, revisão e gestão de documentos críticos que comunicam informações essenciais sobre o produto às partes interessadas, garantindo a conformidade com as normas regulamentares globais. Os componentes principais incluem a Ficha de Dados EssenciaisCDS) e a Ficha de Dados Essenciais da EmpresaCCDS), derivadas de fontes como Brochuras de Investigação e dados pós-comercialização. Este processo é fundamental para a transmissão de informações de segurança e eficácia em rótulos específicos de cada país e para o alinhamento com os requisitos Health Authority (HA) .
Com um enfoque na harmonização global, a rotulagem regulamentar farmacêutica aborda a evolução das exigências regulamentares, abrangendo autorizações de novos produtos, submissões de HA, pós-aprovações e gestão do ciclo de vida. A precisão e a adesão às diretrizes em evolução são cruciais para o sucesso da rotulagem regulamentar farmacêutica, influenciando a autorização de comercialização de um produto, o perfil de segurança e a viabilidade regulamentar geral.

Freyr, líder em Regulatory labeling services end-to-end Regulatory labeling services end-to-end , conta com uma equipa dedicada de mais de 180 especialistas globais em rotulagem, com destaque na elaboração de documentos cruciais, como brochuras de investigação (IB), fichas técnicas de desenvolvimento e informações essenciais de segurança de desenvolvimento. O uso de inteligência artificial aumenta a precisão e agiliza a implementação e revisão das fichas técnicas. Com um CCDS simplificado e processos orientados para a precisão, os serviços abrangentes Freyr atendem de forma eficaz às necessidades dinâmicas da indústria farmacêutica, fornecendo suporte incomparável para a conformidade de rotulagem e o sucesso regulatório.
Porque é que a rotulagem regulamentar é importante na indústria farmacêutica?
- Garantir a segurança dos doentes e a comunicação de informações: A rotulagem regulamentar é crucial para a segurança dos doentes. Os rótulos fornecem informações essenciais sobre a utilização de medicamentos, dosagens, efeitos secundários e contra-indicações. Os doentes, os médicos prescritores, os profissionais de saúde e os prestadores de cuidados de saúde confiam nestes rótulos para tomarem decisões informadas. Uma rotulagem clara e exacta reduz o risco de erros de medicação, acontecimentos adversos e utilização indevida.
Garante que os doentes recebem o tratamento correto e compreendem a sua utilização adequada. Além disso, as autoridades reguladoras exigem que cada produto farmacêutico no mercado tenha uma rotulagem para comunicar eficazmente as informações sobre o tratamento. - Conformidade e mitigação de riscos: A conformidade com os regulamentos de rotulagem não é apenas uma formalidade, é um requisito legal. Órgãos reguladores como a US and Drug Administration (FDA) US , a Agência Europeia de Medicamentos (EMA) e outros exigem uma rotulagem precisa e abrangente. A não conformidade pode resultar em multas regulatórias, danos à reputação da marca e até mesmo paralisações temporárias da linha de produção. As empresas farmacêuticas devem demonstrar que os seus processos, métodos, testes e equipamentos de rotulagem são capazes de produzir produtos seguros e eficazes de forma consistente. A rotulagem devidamente validada mitiga os riscos e garante a adesão às boas práticas de fabrico (BPF).
- Acesso ao mercado e harmonização global: Rótulos bem estruturados facilitam o acesso ao mercado global. A rotulagem consistente em todas as regiões simplifica os processos, reduz as redundâncias e alinha-se com as normas harmonizadas. À medida que os reguladores internacionais adoptam requisitos de validação de GMP, incluindo a serialização, as cadeias de fornecimento farmacêuticas enfrentam uma complexidade crescente. As empresas que dão prioridade à conformidade da rotulagem estabelecem confiança, melhoram a aceitação do mercado e posicionam-se para o sucesso num cenário competitivo.
O que é o processo de aprovação da rotulagem?
O processo de aprovação da rotulagem na indústria farmacêutica envolve várias fases para garantir que todas as informações relacionadas com os medicamentos são exactas, conformes e claras, tanto para os prestadores de cuidados de saúde como para os doentes. Começa com a redação do conteúdo do rótulo, que inclui detalhes sobre a dosagem, administração, segurança e advertências. As equipas médicas e de regulamentação analisam internamente este projeto para garantir que está em conformidade com as normas regulamentares locais e internacionais. Uma vez finalizado, o rótulo é submetido às autoridades de saúde para aprovação, onde é submetido a um escrutínio rigoroso para verificar a sua conformidade com os requisitos de segurança e eficácia. Só depois de receber a aprovação oficial é que o rótulo pode ser utilizado na comercialização do medicamento.
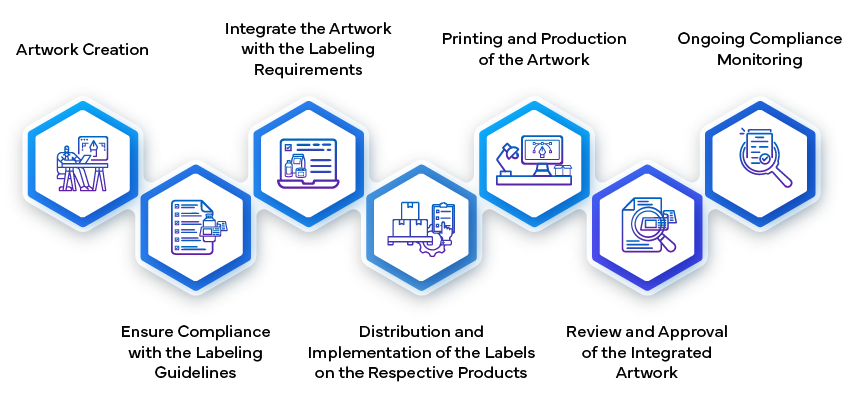
- Criar e enviar a etiqueta:
- Recolha inicial de dados: As empresas farmacêuticas compilam todos os dados relevantes para o rótulo do medicamento. Isto inclui informações sobre eficácia, segurança, dosagens, indicações, contra-indicações e riscos potenciais. O rótulo funciona como uma ferramenta de comunicação fundamental para os profissionais de saúde e os doentes.
- Apresentação às autoridades reguladoras: A empresa apresenta os dados do rótulo a órgãos reguladores, como a US and Drug Administration (FDA) US ou a Agência Europeia de Medicamentos (EMA). Essas agências avaliam os dados para garantir que o medicamento ofereça benefícios que superem os riscos conhecidos e potenciais para a população-alvo.
- Análise contextual: Os revisores analisam a condição ou doença a que o medicamento se destina. Consideram o panorama do tratamento existente, ponderando os riscos do medicamento em relação aos seus benefícios. Por exemplo, um medicamento que trate uma doença potencialmente fatal sem terapia alternativa pode ser aprovado mesmo que os riscos sejam inaceitáveis para uma doença não potencialmente fatal.
- Avaliação de dados clínicos: Os revisores FDA avaliam os benefícios clínicos e as informações de risco apresentadas pelo fabricante do medicamento. Têm em conta quaisquer incertezas resultantes de dados imperfeitos ou incompletos. Normalmente, a agência espera resultados de ensaios clínicos bem concebidos para validar a eficácia e a segurança do medicamento.
- Estabelecendo a Artwork:
- Depois que o conteúdo do rótulo for aprovado, o próximo passo é criar a artwork do rótulo. Isso envolve projetar os elementos visuais, o layout, as fontes e os gráficos. A artwork estar em conformidade com as diretrizes regulamentares e representar com precisão as informações contidas no rótulo.
- artwork da etiqueta artwork revisões internas na empresa farmacêutica para garantir consistência e conformidade. Ela inclui detalhes como instruções de dosagem, advertências, condições de armazenamento e informações de contacto.
- artwork final artwork submetida às autoridades reguladoras para aprovação. Esta etapa garante que a apresentação visual do rótulo cumpra os padrões de qualidade e comunique eficazmente as informações essenciais aos utilizadores.
- Fabrico e implementação:
- Uma vez aprovada, a artwork da etiqueta artwork parte integrante da embalagem do medicamento. Os fabricantes garantem que as etiquetas sejam corretamente afixadas em cada unidade do produto (por exemplo, frascos, embalagens blister, ampolas).
- Os procedimentos de controlo de qualidade verificam se os rótulos cumprem as especificações, incluindo o conteúdo exato, a legibilidade e a adesão às diretrizes de design.
- O rótulo serve de ponte entre a empresa farmacêutica, as agências reguladoras, os prestadores de cuidados de saúde e os doentes. Desempenha um papel vital na garantia de uma utilização segura e eficaz dos medicamentos durante todo o ciclo de vida do produto.
Quais são os desafios comuns na rotulagem regulamentar?
Os desafios comuns na rotulagem regulamentar incluem manter-se a par da evolução dos requisitos regulamentares, gerir a rotulagem multilingue e garantir a consistência em diversas carteiras de produtos. A natureza dinâmica das normas regulamentares para a rotulagem farmacêutica exige uma vigilância contínua para se manter atualizado com os requisitos mais recentes. Adaptar-se às alterações regulamentares e implementar prontamente as actualizações necessárias ao conteúdo e formato da rotulagem é essencial para manter a conformidade e garantir a segurança dos doentes.
| Desafio | Descrição |
|---|---|
| Evolução dos requisitos regulamentares | Lidar com regulamentos e diretrizes em constante mudança, necessitando de actualizações constantes da documentação de rotulagem. |
| Harmonização global | Assegurar a coerência da informação sobre os produtos nas diversas regiões, em conformidade com os diferentes requisitos das diversas autoridades sanitárias. |
| Integração de dados pós-comercialização | Gerir a incorporação de dados de segurança e eficácia pós-comercialização na rotulagem, mantendo a exatidão e a relevância. |
| Conformidade com as normas locais de rotulagem | Cumprir as normas de rotulagem específicas de cada país, tendo em conta as variações linguísticas, culturais e de formatação. |
| Gestão eficiente de alterações na rotulagem | Racionalização dos processos de acompanhamento, implementação e documentação das alterações de rotulagem de forma rápida e exacta. |
A rotulagem multilingue representa um desafio significativo para as empresas farmacêuticas que operam em mercados globais. A tradução exacta do conteúdo da rotulagem em vários idiomas, respeitando as nuances linguísticas e regulamentares regionais, requer atenção aos detalhes e processos robustos de gestão da tradução. Garantir a consistência e a clareza nas diferentes versões linguísticas é crucial para comunicar eficazmente informações vitais a diversas populações de doentes.
Manter a consistência entre as carteiras de produtos representa outro desafio comum na rotulagem regulamentar. As empresas farmacêuticas gerem frequentemente vários produtos com diferentes requisitos de rotulagem, formulações e indicações. Alcançar a coerência e a conformidade em diversas linhas de produtos, satisfazendo simultaneamente as exigências regulamentares específicas de cada produto, requer processos e sistemas eficientes para garantir a uniformidade do conteúdo, formato e mensagens da rotulagem.
Quais são os principais regulamentos que regem a rotulagem farmacêutica?
A rotulagem farmacêutica é regida por um conjunto complexo de regulamentos destinados a garantir a segurança, a eficácia e a utilização correta dos medicamentos. Alguns deles estão listados abaixo:
FDA US FDA Administração de Alimentos e Medicamentos dos Estados Unidos)
FDA US FDA a rotulagem farmacêutica através de um conjunto rigoroso de regulamentos descritos no Código de Regulamentos Federais (CFR) Título 21. Esses regulamentos exigem que os rótulos forneçam informações abrangentes, incluindo indicações do medicamento, instruções de uso, contraindicações e possíveis efeitos colaterais. A FDA a importância de uma linguagem clara, precisa e inequívoca para garantir a segurança do paciente e a tomada de decisões informadas pelos profissionais de saúde. Além disso, os requisitos de rotulagem FDA se estendem a vários aspetos, como embalagens, folhetos e rotulagem eletrónica, garantindo que todas as informações sejam acessíveis e padronizadas em diferentes formatos. A conformidade com essas regulamentações é obrigatória para a aprovação de medicamentos e a presença contínua no mercado dos Estados Unidos.
EMA (Agência Europeia de Medicamentos)
A EMA supervisiona a rotulagem farmacêutica na União Europeia através de diretivas e orientações concebidas para harmonizar a rotulagem nos member states. A Diretiva 2001/83/CE European Commission é fundamental para estes esforços, especificando os requisitos para o Resumo das Caraterísticas do MedicamentoSmPC), os folhetos informativos para os doentes e os rótulos das embalagens. A EMA garante que a rotulagem inclui informações essenciais tanto para os profissionais de saúde como para os doentes, promovendo uma utilização segura e eficaz dos medicamentos em toda a EU (European Union). Além disso, a rotulagem deve estar disponível nas línguas oficiais dos member states onde o medicamento é comercializado, reflectindo o compromisso da EMA para com a acessibilidade e os cuidados centrados no doente.
TGA (Therapeutic Goods Administration)
Na Austrália, a TGA é responsável pela regulamentação da rotulagem farmacêutica ao abrigo do Therapeutic Goods Act de 1989. As diretrizes da TGA exigem que os rótulos dos medicamentos forneçam informações claras, precisas e completas sobre o produto, incluindo os seus ingredientes, indicações, dosagem e riscos potenciais. Os requisitos de rotulagem destinam-se a proteger a saúde pública, garantindo que os consumidores e os profissionais de saúde dispõem da informação necessária para utilizar os medicamentos de forma segura e eficaz. A TGA também coloca uma ênfase significativa na legibilidade dos rótulos, exigindo que sejam escritos em inglês simples e que as informações críticas sejam exibidas de forma proeminente para evitar o uso indevido e erros de medicação.
Health Canada
Health Canada regulamenta a rotulagem farmacêutica através de um quadro que dá prioridade à segurança e ao bem-estar dos pacientes e dos prestadores de cuidados de saúde. A Lei sobre Alimentos e Medicamentos e os regulamentos associados definem os requisitos para os rótulos dos medicamentos, que devem incluir informações pormenorizadas sobre a composição do produto, as indicações, as contra-indicações e os potenciais efeitos secundários. O Ministério Health Canada do Health Canada também exige que os rótulos sejam bilingues, apresentados em inglês e francês, para ter em conta a diversidade linguística do país. Além disso, Health Canada actualiza regularmente os seus requisitos de rotulagem para refletir novas provas científicas e a evolução das necessidades de saúde pública, assegurando que a rotulagem permanece relevante e eficaz na promoção da utilização segura dos medicamentos.
PMDA (Agência dos Produtos Farmacêuticos e dos Dispositivos Médicos)
A PMDA, a autoridade reguladora do Japão, supervisiona a rotulagem farmacêutica de acordo com a Lei dos Assuntos Farmacêuticos e as diretrizes relacionadas. A PMDA exige que os rótulos dos medicamentos forneçam informações completas, incluindo indicações, instruções de dosagem e potenciais efeitos adversos, num formato que seja facilmente compreendido pelos profissionais de saúde e pelos doentes. A PMDA também exige que os rótulos incluam avisos e precauções específicos para a população japonesa, considerando factores como as diferenças genéticas e as práticas culturais. Esta abordagem garante que os medicamentos são utilizados de forma segura e eficaz no Japão, com uma rotulagem adaptada às necessidades únicas do mercado local.
NMPA (Administração Nacional de Produtos Médicos)
Na China, a NMPA rege a rotulagem farmacêutica através de um quadro regulamentar que privilegia a exatidão, a clareza e a segurança. A Lei de Administração de Medicamentos da República Popular da China define os requisitos para os rótulos dos medicamentos, que devem incluir informações sobre as indicações do medicamento, a dosagem, as contra-indicações e os potenciais efeitos secundários. A NMPA também exige que a rotulagem seja apresentada em chinês simplificado para garantir a acessibilidade da população local. Além disso, a NMPA exige que os rótulos sejam objeto de uma análise rigorosa durante o processo de aprovação dos medicamentos, a fim de garantir a conformidade com as normas nacionais e proteger a saúde pública através da prevenção de erros de medicação e de utilização indevida.
Como é que um parceiro de regulamentação pode ajudar a alcançar a conformidade com os requisitos de rotulagem?
Um parceiro regulatório é fundamental para alcançar a conformidade com os requisitos de rotulagem, oferecendo conhecimentos especializados e suporte abrangente. Ele orienta as empresas no complexo cenário regulatório, garantindo que os materiais de rotulagem — incluindo embalagens, folhetos e rótulos eletrónicos — cumpram os requisitos específicos de diferentes autoridades sanitárias, como aFDA US , EMA, a TGA, Health Canada, PMDA e NMPA. Isso envolve compreender e aplicar as regulamentações mais recentes, que podem variar significativamente entre as regiões, para garantir que todas as informações do produto sejam precisas, completas e em conformidade.
Além disso, um parceiro regulador ajuda a simplificar o processo de rotulagem, fornecendo serviços críticos como a criação, revisão e validação de conteúdo. Ajudam a redigir e a rever o conteúdo da rotulagem para se alinharem com as normas regulamentares e asseguram a inclusão de todas as informações necessárias, desde listas de ingredientes e instruções de utilização a avisos de segurança e condições de armazenamento. Isto reduz o risco de erros e omissões que poderiam levar a atrasos regulamentares ou à retirada do mercado, acelerando o tempo de colocação no mercado de novos produtos.

Além disso, um parceiro regulamentar apoia as empresas na manutenção da conformidade contínua, monitorizando as actualizações regulamentares e implementando alterações conforme necessário. Oferecem aconselhamento estratégico sobre a adaptação dos rótulos a novas diretrizes ou requisitos de mercados emergentes, ajudando as empresas a evitar problemas de não conformidade e assegurando que os seus produtos permanecem em linha com os regulamentos actuais. Ao tirar partido da sua experiência e ao manter-se a par das alterações regulamentares, um parceiro regulamentar ajuda as empresas a navegar no dinâmico panorama da rotulagem de forma eficiente e eficaz.
Como é que as empresas podem começar a utilizar os Regulatory Labeling Services?
Para começar a utilizar os Regulatory labeling services, as empresas devem começar por avaliar as suas necessidades específicas de rotulagem com base nos mercados-alvo e nos requisitos regulamentares. Em seguida, devem estabelecer uma parceria com um fornecedor de serviços regulamentares fiável, com experiência em normas de rotulagem globais. Este fornecedor pode ajudar a redigir, rever e atualizar os rótulos para garantir a conformidade. Além disso, a implementação de um sistema centralizado de gestão de rótulos ajuda a simplificar o processo, garantindo a consistência em todos os rótulos dos produtos. As auditorias e actualizações regulares são essenciais para manter os rótulos alinhados com os regulamentos em evolução.
Avaliar as necessidades regulamentares:
- Identificar os requisitos regulamentares específicos aplicáveis ao seu produto e mercados-alvo.
- Compreender documentos críticos, tais como Fichas de Dados EssenciaisCDS), Brochuras de InvestigaçãoIB) e requisitos de rotulagem locais.
Selecionar um parceiro de rotulagem regulamentar:
- Pesquise e escolha um fornecedor de serviços de rotulagem regulamentar de renome com experiência no seu sector.
- Considere factores como a experiência, o conhecimento global da regulamentação e a capacidade de lidar com diversos desafios de rotulagem.
Definir o âmbito do projeto:
- Definir claramente o âmbito do seu projeto de rotulagem regulamentar, incluindo o tipo de serviços necessários (por exemplo, elaboração de IB , criação de CCDS , revisão da conformidade da rotulagem).
- Estabelecer prazos, marcos e resultados para cada fase do projeto.
Colaborar na recolha de dados:
- Colabore estreitamente com o seu parceiro de rotulagem regulamentar escolhido para reunir dados essenciais, incluindo informações de ensaios clínicos, dados de segurança e eficácia e quaisquer Vigilância Pós-Comercialização .
Iniciar a criação e revisão de documentos:
- Iniciar a criação ou revisão de documentos cruciais, tais como IBs, DCDS, CCDS e conteúdo de rotulagem local.
- Facilitar revisões regulares e sessões de feedback para garantir a exatidão e o alinhamento com os requisitos regulamentares.
Implementar processos de controlo de alterações:
- Desenvolver processos sólidos de controlo de alterações para rotular actualizações e acompanhar prontamente quaisquer alterações aos documentos principais.
- Assegurar que as alterações são implementadas de forma coerente nos rótulos globais e regionais.
Monitorizar a conformidade:
- Estabelecer mecanismos de controlo permanente do cumprimento das normas regulamentares em evolução.
- Mantenha-se informado sobre as alterações nos regulamentos e actualize os documentos de rotulagem em conformidade.
Utilizar a tecnologia e a automatização:
- Tire partido do software e da tecnologia de etiquetagem regulamentar para melhorar a precisão, a eficiência e a gestão de documentos.
- Explorar ferramentas que suportem a inteligência artificial para simplificar os processos de implementação e revisão de fichas de dados.
Envolver peritos em matéria de regulamentação:
- Envolva especialistas em regulamentação ou consultores dentro da sua organização ou através do fornecedor de serviços escolhido para fornecer conhecimentos e orientação ao longo do processo de rotulagem.
Melhoria contínua:
- Estabelecer uma cultura de melhoria contínua, revendo e aperfeiçoando regularmente os processos de rotulagem com base no feedback, nas mudanças do sector e na evolução dos cenários regulamentares.
Regulatory Labeling Services podem ajudar na monitorização pós-comercialização?
Sim, Regulatory labeling services podem, de facto, ajudar na monitorização pós-comercialização de produtos farmacêuticos. Estes serviços desempenham um papel crucial no apoio à vigilância pós-comercialização, facilitando a gestão das actualizações de rotulagem, tratando das alterações de rotulagem relacionadas com a segurança e garantindo a conformidade com os requisitos regulamentares pós-aprovação. Ao manter informações de rotulagem exactas e actualizadas, Regulatory labeling services ajudam as empresas farmacêuticas a responder a preocupações de segurança e a implementar atempadamente as alterações necessárias para apoiar a conformidade regulamentar contínua e a segurança dos doentes.
Além disso, Regulatory labeling services podem ajudar na divulgação eficiente de informações de segurança actualizadas aos profissionais de saúde e aos doentes. No caso de novas descobertas de segurança ou de alterações nos perfis de risco dos produtos farmacêuticos, os especialistas em rotulagem regulamentar podem ajudar a atualizar rapidamente o conteúdo da rotulagem para refletir os dados de segurança mais recentes e os requisitos regulamentares. Esta abordagem proactiva à monitorização pós-comercialização e às actualizações de rotulagem apoia a comunicação atempada de informações de segurança importantes aos prestadores de cuidados de saúde e aos doentes, contribuindo para uma melhor farmacovigilância e cuidados aos doentes.
Em geral, Regulatory labeling services fornecem um apoio valioso na monitorização pós-comercialização, garantindo que os produtos farmacêuticos mantêm uma rotulagem exacta e em conformidade ao longo do seu ciclo de vida. Ao tirar partido da experiência dos profissionais da área da regulamentação e de processos eficientes de gestão da rotulagem, as empresas podem abordar eficazmente as considerações de segurança pós-comercialização e as obrigações regulamentares, contribuindo assim para a segurança e eficácia contínuas dos seus produtos no mercado.
Porquê escolher Freyr?
Uma década de excelência na rotulagem regulamentar
Mais de 180 especialistas mundiais em serviços de rotulagem
Especialista na criação e gestão de documentos essenciais
Conhecimentos especializados em brochuras de investigação, fichas de dados principais e fichas de dados principais da empresa
Empenhado na conformidade e precisão globais
Utiliza AI (Artificial Intelligence) para uma navegação regulamentar eficiente
Factos rápidos
+
+
+
Perguntas mais frequentes
As Fichas de Dados EssenciaisCDS) fornecem um resumo consolidado de informações críticas sobre medicamentos, incluindo indicações, dosagens e perfis de segurança. Asseguram uma comunicação consistente de pormenores essenciais nos mercados globais, facilitando a conformidade regulamentar e a tomada de decisões informadas. CDS também servem de referência para a criação de rótulos de produtos locais.
As brochuras de investigação (IB) detalham os dados dos ensaios clínicos e as informações sobre o desenvolvimento de medicamentos para uso investigativo, enquanto as fichas de dados essenciais da empresa (CCDS) resumem os principais dados de segurança e eficácia para fins regulatórios globais, orientando o conteúdo e as atualizações dos rótulos. CCDS utilizadas para criar rótulos específicos para cada produto para aprovação no mercado.
A inteligência artificial melhora a rotulagem regulamentar, automatizando a análise de dados, melhorando a precisão na criação de conteúdos e acelerando as revisões de documentos. As ferramentas de IA simplificam os processos de rotulagem e garantem a consistência entre diversos requisitos regulamentares. Ajudam também a prever e a resolver potenciais problemas de conformidade.
A rotulagem multilingue garante que os produtos farmacêuticos são acessíveis a diversas populações de doentes, satisfazendo os requisitos regulamentares regionais e aumentando a segurança, fornecendo instruções e avisos claros e compreensíveis em várias línguas. Isto reduz o risco de falhas de comunicação e erros na administração de medicamentos.
Um sistema centralizado de gestão de rotulagem coordena a criação, revisão e atualização de documentos de rotulagem, assegurando a consistência e a conformidade nos mercados globais. Simplifica os processos e mantém informações precisas e actualizadas sobre os produtos. Este sistema também suporta o tratamento eficiente de alterações de rotulagem e actualizações regulamentares.
Structured Product Labeling (SPL) é um formato XML utilizado para a rotulagem de medicamentos que normaliza e organiza a informação sobre o produto. Garante a coerência e facilita o intercâmbio de dados entre as agências reguladoras e os fabricantes. O SPL apoia a gestão eficiente das informações de rotulagem ao longo do ciclo de vida de um produto.
O Global Location Number (GLN) é um identificador único utilizado para identificar localizações e entidades na cadeia de abastecimento. Ajuda a seguir e a gerir com precisão os produtos farmacêuticos nos mercados globais. Os GLN asseguram uma distribuição precisa e eficiente dos produtos e a gestão do inventário.
O Código Nacional de Medicamentos (NDC) é um identificador único para medicamentos, atribuído pela FDA. Ajuda na identificação exacta dos medicamentos e facilita a gestão e o acompanhamento do inventário. O NDC é crucial para a distribuição exacta de medicamentos e para a elaboração de relatórios regulamentares.
Uma Brochura do InvestigadorIB) fornece informações pormenorizadas sobre os dados clínicos e pré-clínicos de um medicamento experimental. É utilizada para informar os investigadores de ensaios clínicos sobre a segurança, a eficácia e a dosagem do medicamento para efeitos de estudo. A IB também apoia a tomada de decisões éticas e informadas na investigação clínica.












