BIMO significa Bioresearch Monitoring (Monitorização de Investigação Biológica), um programa de inspeção no local e auditorias de dados para monitorizar todos os aspetos da conduta e relatórios da investigação regulamentada US and Drug Administration (FDA) US . O programa foi criado em 1977, após a identificação da necessidade de auditar locais de investigação clínica. O principal objetivo deste programa é garantir a qualidade e a integridade dos dados apresentados para aprovações de novos produtos e pedidos de comercialização. Além disso, este programa também protege os direitos e o bem-estar de seres humanos e animais envolvidos na investigação FDA.
Os principais objectivos do programa BIMO
Anualmente, são realizadas mais de 1000 inspecções. Os principais objectivos abrangidos pelo programa BIMO são:
- Auditar dados clínicos
- Inspeção da investigação clínica em curso
- Inspeção de laboratórios não clínicos
- Inspeção dos Conselhos de Revisão Institucional (IRB)
Que produtos são abrangidos pelo âmbito de aplicação da BIMO Audit?
O BIMO é aplicável a medicamentos, produtos biológicos, dispositivos médicos, produtos alimentícios, produtos de tabaco e produtos veterinários. O programa de conformidade é supervisionado pelos seis (06) centros de produtos da FDA- Centro de Avaliação e Pesquisa Biológica (CBER), Centro de Dispositivos e Saúde Radiológica (CDRH), Centro de Avaliação e Pesquisa de Medicamentos (CDER), Centro de Segurança Alimentar e Nutrição Aplicada (CFSAN), Centro de Produtos de Tabaco (CTP) e Centro de Medicina Veterinária (CVM).
Que empresas são objeto de BIMO Audit?
Tanto as empresas nacionais como as internacionais que realizem ou se enquadrem em qualquer uma das actividades abaixo indicadas estão sujeitas aos requisitos da Monitorização da Investigação Biológica
- Laboratórios de ensaios não clínicos para cumprimento das Boas Práticas de LaboratórioGLP)
- Investigadores clínicos para conformidade com as Boas Práticas Clínicas (BPC)
- Patrocinadores
- Organizações de Investigação Contratadas (CROs)
- Monitores de ensaios clínicos
- Instalações de bioequivalência in vivo
- Conselhos de Revisão Institucional (IRBs)
Que programas de conformidade são abrangidos pelo Programa BIMO?
FDA US FDA realizar uma auditoria BIMO a qualquer momento através dos sete (07) programas de conformidade multicêntricos. Esses sete programas de conformidade multicêntricos são implementados através de:
- Inspeção do Investigador Clínico (IC) e do Investigador Patrocinador (SI)
- Inspeção do Conselho de Revisão Institucional (IRB)
- Inspeção de Organizações de Investigação Contratadas/Patrocinador/MonitorCRO)
- Inspeção de Boas Práticas de LaboratórioGLP)
- Inspeção da Bioequivalência-Biodisponibilidade (BEQ)
- Inspeção da comunicação de experiências adversas com medicamentos após a comercialização (PADE)
- Avaliação, atenuação e estratégia dos riscos (REMS) Inspeção de relatórios
Cada um destes programas define um âmbito detalhado de revisão ou inspeção a realizar para garantir a conformidade com a FDA.
Que regulamentos são aplicáveis à auditoria BIMO?
Os regulamentos - 21 CFR 50 - Proteção dos sujeitos humanos, 21 CFR 54-Divulgação financeira, 21 CFR 56-IRBs, 21 CFR 58-Boas práticas de laboratório para laboratórios não clínicos, 21 CFR 809-Produtos de diagnóstico in vitro e 21 CFR 812-Isenção de dispositivos de investigação são aplicáveis à auditoria BIMO.
Quantas auditorias são efectuadas anualmente no âmbito do Programa BIMO?
O número de auditorias BIMO realizadas pelaFDA US FDA a cada ano. Nos últimos anos, o número de inspeções no local diminuiu devido ao início da pandemia da COVID-19, e a FDA que suspender toda a vigilância no local dos estudos clínicos. Apenas estudos clínicos críticos e cruciais específicos estavam a ser monitorados.
As "Avaliações Regulamentares à Distância" (ARR) foram introduzidas durante a pandemia de COVID-19 para monitorizar à distância a investigação regulamentada. As ARR são realizadas através de videoteleconferências e constituem uma iniciativa voluntária de avaliação à distância dos dados e processos. No entanto, o facto a salientar aqui é que as ARR não são equivalentes ou uma alternativa à inspeção no local, sendo apenas um procedimento que evoluiu devido à pandemia de COVID-19.
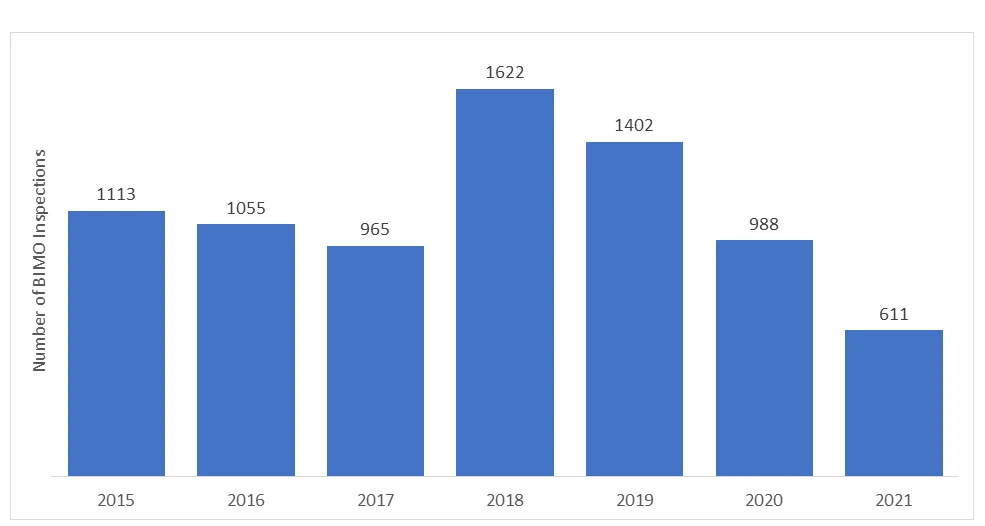
*Os dados representados para os anos de 2020 e 2021 não incluem as inspecções RRA
Quantas avaliações regulamentares à distância (RRA) foram efectuadas durante a pandemia de COVID-19 no âmbito do programa BIMO?
Em 2021, a adoção da inspeção RRA aumentou significativamente em todos os programas. Em abril de 2021, a FDA publicou um documento de orientação sobre "Avaliações interactivas remotas de instalações de fabrico de medicamentos e de monitorização de investigação biológica durante a emergência de saúde pública COVID-19 - orientações para a indústria", que fornece informações exaustivas sobre o processo da FDApara a realização de RRA.
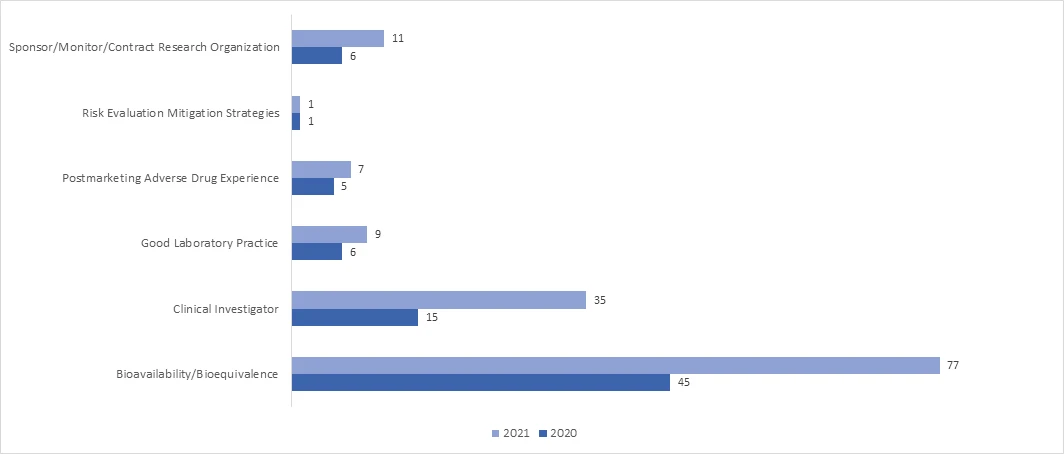
Quais são os resultados possíveis de uma auditoria BIMO?
Durante a auditoria da BIMO, aFDA US FDA decidir tomar qualquer uma das medidas listadas abaixo com base na conformidade –
1. Nenhuma ação indicada (NAI)
A NAI é aplicável quando o inspetor no terreno FDA não identificou qualquer prática censurável ou apenas questões menores para as quais não se justifica uma ação adicional.
2. Ação Voluntária Indicada (VAI)
O VAI é aplicável quando foram identificadas práticas censuráveis, mas não são significativas.
3. Ação oficial indicada (OAI)
O IAO é aplicável quando são identificadas práticas censuráveis que comprometem a integridade dos dados e/ou os direitos das pessoas em causa.
Quais são as não-conformidades mais comuns emitidas no âmbito do BIMO Audit?
Algumas das não-conformidades mais comuns observadas durante a Auditoria BIMO são
- Não manter um registo adequado dos registos
- Incumprimento do plano de investigação
- Não cumprimento dos regulamentos
- Falha no controlo dos protocolos
- Proteção inadequada dos sujeitos
- Responsabilização inadequada do produto que está a ser investigado
A auditoria BIMO é crucial para qualquer desenvolvedor ou fabricante de dispositivos e tecnologias médicas inovadoras que planeja lançar o seu dispositivo no US . É muito importante cumprir os regulamentos e diretrizes para evitar qualquer uma das armadilhas descritas.
Necessita de assistência no âmbito das inspecções de auditoria BIMO? Reach em contacto com Freyr. Mantenha-se informado. Mantenha-se em conformidade.