A Notificação de Dispositivos Médicos (MDR) é uma ferramenta de vigilância pós-comercialização que a Food and Drug AdministrationFDA) utiliza para monitorizar o desempenho dos dispositivos, detetar potenciais problemas de segurança relacionados com os dispositivos e contribuir para avaliações de risco-benefício dos dispositivos. O objetivo da MDR é detetar e tratar atempadamente os eventos adversos relacionados com os dispositivos. Permite aos médicos, estabelecimentos de cuidados de saúde, fabricantes e consumidores, através da comunicação voluntária, compreender a segurança e a eficácia do dispositivo após a sua comercialização.
O RDM é aplicável a todas as classes de dispositivos médicos, fabricados nos Estados Unidos da América (EUA) ou importados para os EUA. Os fabricantes de dispositivos médicos que pretendam comercializar os seus dispositivos nos EUA têm de cumprir o RDM, sob pena de incorrerem em sanções financeiras. É aplicável nos EUA, incluindo um evento estrangeiro, ou seja, é aplicável a dispositivos médicos legalmente comercializados nos Estados Unidos, tanto fabricados nos EUA como em países estrangeiros. Além disso, existem vários casos de aplicabilidade de um MDR, tais como:
- se um dispositivo for fabricado nos EUA, distribuído localmente e noutros mercados
- quando um dispositivo é fabricado nos EUA mas distribuído noutros mercados
- quando um dispositivo é fabricado no país estrangeiro, fornecido nos EUA e noutros mercados
- quando um dispositivo é fabricado no país estrangeiro e distribuído localmente e
- quando um dispositivo está a ser investigado nos EUA
MDR e o fluxo do processo de comunicação
O regulamento MDR contém muitos requisitos obrigatórios para que os fabricantes, importadores e instalações de utilizadores de dispositivos comuniquem à FDA determinados eventos adversos relacionados com dispositivos e problemas com produtos. O fluxograma de processo fornecido abaixo detalha o processo de notificação passo a passo.
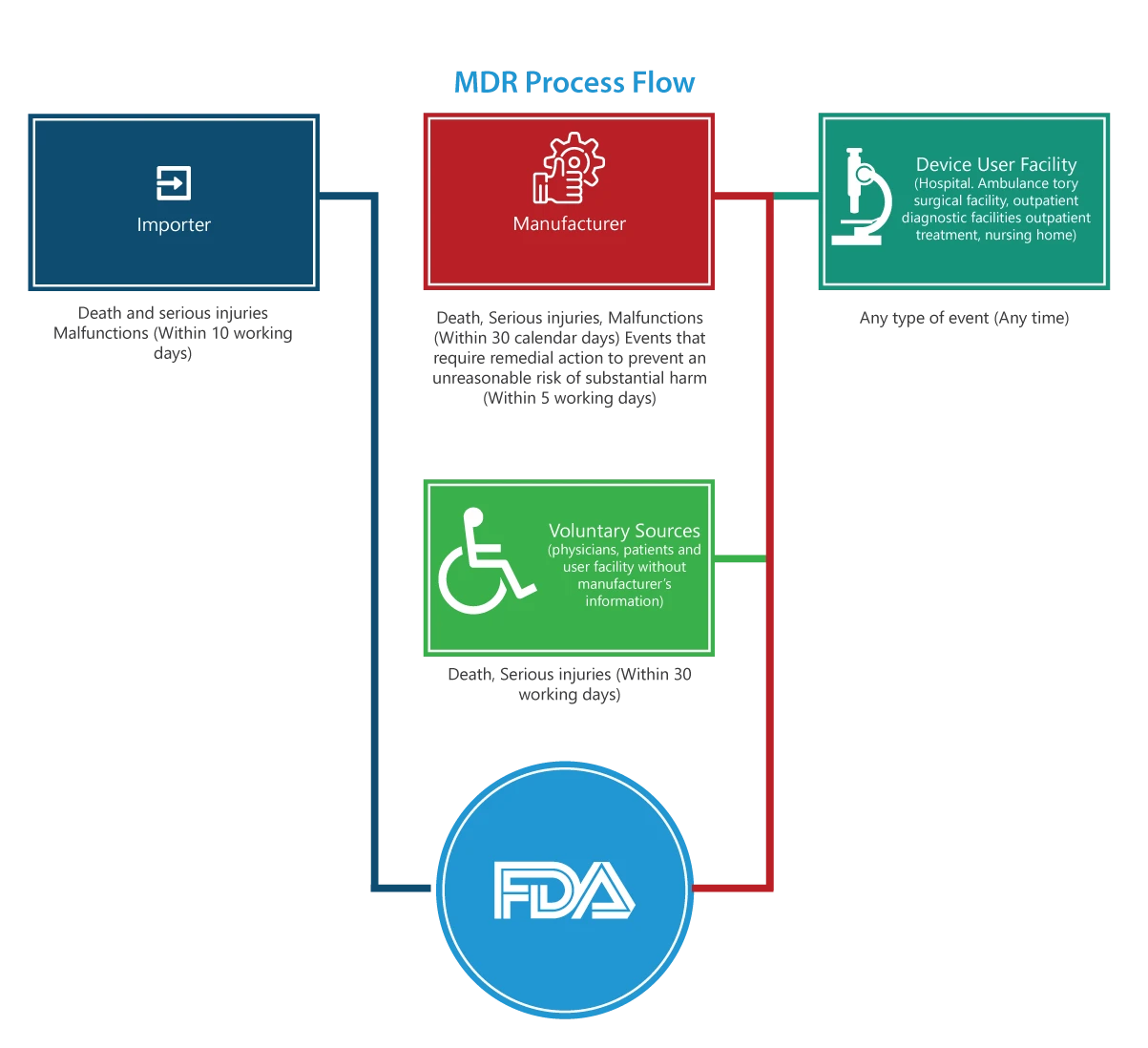
A quem se aplica?
Importadores
As comunicações de mortes, ferimentos graves e avarias devem ser apresentadas à FDA e ao fabricante no prazo de 30 dias úteis. Se a avaria puder causar ferimentos ou mortes noutro local, os importadores devem comunicar a avaria ao fabricante.
Fabricantes
Os relatórios relativos a um evento (mortes, ferimentos graves e avarias) designado pela FDA ou a um evento que exija medidas corretivas para evitar um risco irrazoável de danos substanciais para a saúde pública devem ser apresentados à FDA no prazo de 5 dias úteis, preenchendo o formulário 3500A.
Estabelecimento utilizador do dispositivo (hospital, centro cirúrgico ambulatório, lar de idosos, centro de diagnóstico ambulatório ou centro de tratamento ambulatório)
Os relatórios devem ser apresentados ao fabricante do dispositivo no prazo máximo de 10 dias úteis após o dia em que o estabelecimento toma conhecimento da informação de que um dispositivo causou ou pode ter causado ou contribuído para uma lesão grave num doente do estabelecimento. Se o fabricante for desconhecido, o estabelecimento deve apresentar o relatório à FDA.
Grupos de voluntariado
Os doentes, profissionais de saúde e consumidores que encontrem um problema relacionado com um dispositivo médico podem comunicar à FDA através do MedWatch
eMDR
Em 2015, a FDA impôs o MDR eletrónico (eMDR) para identificar questões críticas de qualidade e integridade dos dados associadas à comunicação de lesões graves relacionadas com todas as classes de dispositivos médicos.
Os fabricantes podem apresentar os seus eMDR através de um Electronic Submissions GatewayESG). A partir do momento da apresentação, o portal eletrónico demora até 48 horas a enviar um aviso de receção. Se houver algum erro durante a apresentação do relatório, aparecerá uma mensagem para fazer a(s) correção(ões).
eMDR - Quais são os seus benefícios?
O eMDR oferece múltiplas vantagens em relação ao mecanismo de notificação manual (ou seja, MDR). De seguida, apresentam-se algumas vantagens notáveis que os fabricantes/agências/pacientes podem aproveitar:
- A ferramenta de submissão eMDR melhora a colaboração entre uma organização, a agência de saúdeFDA) e os pacientes.
- O eMDR poupa custos. A automatização reduz a necessidade de despesas administrativas e de comunicação tradicional; ajuda a acelerar o processo e promove a comunicação eficaz de eventos, resultando numa interação imediata com a FDA.
- Os processos manuais envolvem muita papelada, podem ser morosos e difíceis de controlar e processar. A submissão de eMDR é automatizada e centralizada. Os registos podem ser recuperados facilmente, poupando muito tempo durante a revisão.
- O eMDR permite que as partes assinalem rapidamente os erros de apresentação, por oposição à correspondência manual e morosa com a FDA.
- O eMDR funciona como um ponto de entrada único para processar todas as submissões electrónicas num ambiente altamente seguro e é benéfico porque as queixas na organização podem ser ligadas diretamente ao formulário MedWatch e integradas no portal da FDA.
eMDR e o fluxo do processo de comunicação
O regulamento eMDR contém requisitos obrigatórios para os fabricantes, importadores e instalações de utilizadores de dispositivos comunicarem à FDA determinados eventos adversos relacionados com os dispositivos e problemas com os produtos. O fluxograma abaixo detalha o processo de notificação passo a passo.
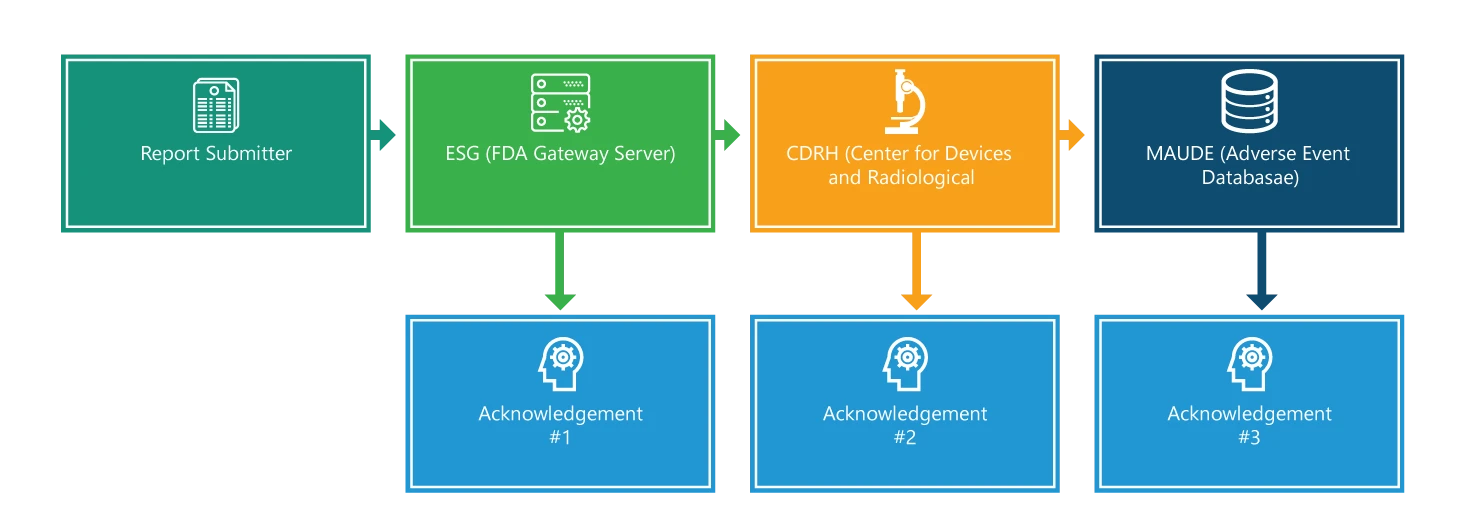
O processo de comunicação é composto por quatro etapas. Com exceção da primeira etapa, cada etapa é reconhecida. Além disso, cada etapa é acompanhada de informações adicionais que ajudarão a facilitar o processo.
Passo 1: Apresentador de relatórios
Envio de um eMDR. Para começar, para fazer um envio, deve-se ter uma assinatura eletrónica e garantir que os nomes dos ficheiros enviados incluam apenas um ponto, que é usado para indicar a extensão do tipo de ficheiro (por exemplo, 555.xml 555.pdf). No entanto, o tempo submissão e processamento submissão depende do tamanho total do seu envio; envios maiores levam mais tempo para serem entregues e processados.
Etapa 2: Electronic Submissions GatewayESG)
Quando a sua apresentação chegar ao ESG, deverá receber rapidamente um aviso de receção n.º 1, exceto se o ESG estiver em manutenção. É necessário verificar o estado do seu MDR no sítio Web ESG .
Etapa 3: CRDH
O eMDR é automaticamente encaminhado do ESG para o Centro de Dispositivos e Saúde Radiológica (CDRH). Uma vez encaminhado, como no passo 2, deve receber um aviso de receção, ou seja, o número 2.
Etapa 4: Experiência do dispositivo do fabricante e do utilizador (MAUDE)
Quando o CDRH valida e actualiza a apresentação na base de dados de eventos adversos (MAUDE), espera-se que o transmitente receba um aviso de receção n.º 3. É de notar que quaisquer erros que ocorram durante a validação e o carregamento são registados.
A comunicação de dispositivos médicos (MDR) é um processo fundamental que ajuda a salvar vidas e a proteger os doentes de riscos desnecessários. Garante que todas as partes envolvidas no tratamento dos doentes são responsáveis e estão atentas à utilização dos dispositivos.
O eMDR facilita a elaboração de relatórios, mas a documentação e o acompanhamento podem consumir muitos recursos. Faça-o bem à primeira; fale us em sales@freyrsolutions.com.