Ninsho (certificação de dispositivos médicos) é um sistema de certificação de terceiros no Japão, no qual um Organismo de Certificação Registado (RCB), acreditado pelo Ministro da Saúde, Trabalho e Bem-Estar (MHLW), certifica dispositivos médicos altamente controlados designados. É aplicável a dispositivos de Classe II e a um número limitado de dispositivos de Classe III que têm uma Norma Industrial Japonesa (JIS) associada. Alguns dispositivos médicos de Classe II sem critérios de certificação estabelecidos requerem aprovação ao abrigo do programa Shonin.
Quais são as outras vias de registo de dispositivos no Japão?
No Japão, as vias Todokede e Shonin também são utilizadas para aprovações de dispositivos médicos, para além da via Ninsho. Dependendo da categoria de risco do dispositivo e da disponibilidade de predicados no Japão, o fabricante deve planear cuidadosamente a apresentação do seu dispositivo.
Quais são os pré-requisitos para a Certificação Ninsho?
Os fabricantes que registam os seus dispositivos através da via Ninsho devem planear meticulosamente as apresentações em termos do seguinte:
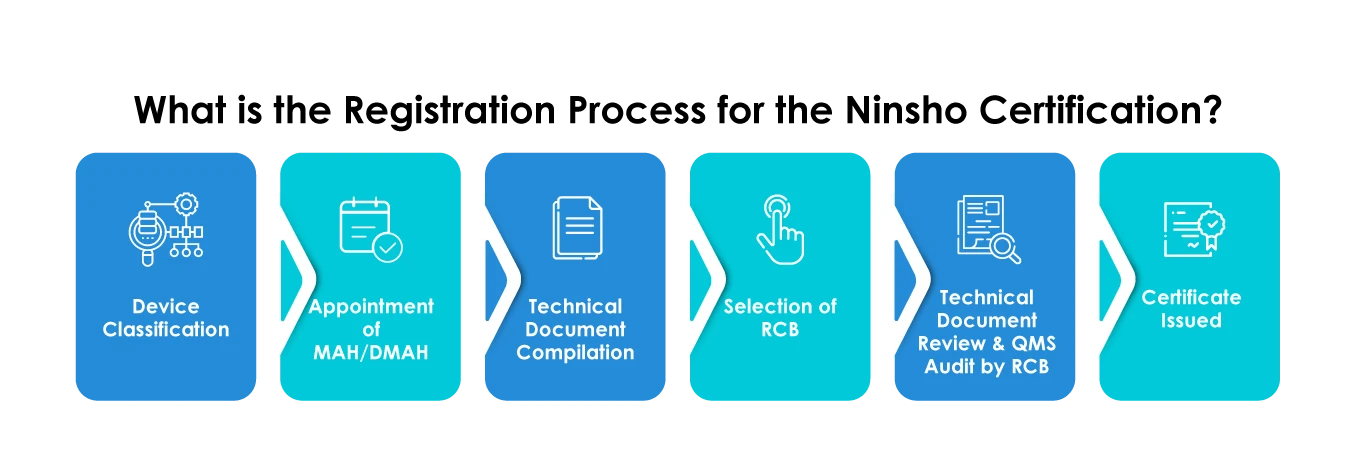
- Seleção de um RCB
- Apresentação de dados gerais sobre os dispositivos, como a categoria do dispositivo médico, a utilização prevista, os dados da análise de risco da eficácia, os dados clínicos, etc.
- Fornecimento de um resumo da documentação técnica (STED)
- A apresentação de documentos deve ser feita apenas em japonês
- Os fabricantes estrangeiros devem obrigatoriamente nomear um Autorização de Introdução no Mercado (MAH) ou um Autorização de Introdução no Mercado Designado Autorização de Introdução no Mercado (DMAH).
- Os fabricantes estrangeiros devem registar-se no MHLW obter um certificado de Registo de Fabricante Estrangeiro (FMR) para os seus estabelecimentos de fabrico.
O que são os RCB?
Os Organismos de Certificação Registados (RCBs) são organismos de certificação terceirizados acreditados pelo MHLW. Os RCBs são responsáveis pela revisão e certificação de dispositivos médicos elegíveis e aplicados sob a via Ninsho. Os RCBs também são responsáveis pela realização da auditoria do SGQ das instalações do fabricante.
Quais são os requisitos do SGQ para o registo de dispositivos ao abrigo da via Ninsho?
Os fabricantes devem cumprir todos os requisitos do SGQ definidos na Portaria 169. O MAH ou DMAH deve apresentar a submissão RCBs. Os RCBs realizarão uma inspeção detalhada do SGQ nas instalações do fabricante e, após a implementação satisfatória do SGQ, emitirão o certificado.
Qual é o tempo médio necessário para a certificação Ninsho?
O RCB normalmente requer de três (03) a cinco (05) meses para concluir a avaliação técnica, executar a auditoria do SGQ e emitir o certificado Ninsho.
Existe algum prazo de validade para a Certificação Ninsho?
O registo do dispositivo médico não expira, mas o promotor deve renovar os certificados do SGQ a cada cinco (05) anos.
O Japão, sendo o terceiro maior mercado de dispositivos médicos depois dos EUA e da China, oferece grandes oportunidades para fabricantes de dispositivos médicos em todo o mundo. Os fabricantes que desejam comercializar os seus dispositivos no Japão devem planear cuidadosamente a certificação e aprovação dos dispositivos médicos, uma vez que PMDA requisitos regulamentares específicos. Os fabricantes podem optar por um parceiro regulatório confiável para ter acesso sem complicações ao mercado japonês.
Para saber mais sobre a certificação de dispositivos médicos no Japão ou quaisquer outros regulamentos PMDA , entre em contacto com Freyr hoje mesmo!