Os dispositivos médicos inovadores são essenciais para melhorar os resultados dos cuidados de saúde, responder à evolução das necessidades médicas e fornecer soluções rentáveis aos doentes e aos prestadores de cuidados de saúde. A estratégia SAKIGAKE é um processo acelerado de análise e aprovação de dispositivos médicos inovadores no Japão. Esta estratégia foi iniciada pelo Ministério da Saúde, Trabalho e Bem-Estar do JapãoMHLW) em 2015, com o objetivo de acelerar o desenvolvimento e a comercialização de dispositivos médicos inovadores no Japão.
No âmbito da estratégia SAKIGAKE, os dispositivos médicos que satisfazem determinados critérios de inovação podem receber análise e aprovação prioritárias por parte da Pharmaceuticals and Medical Devices AgencyPMDA), a agência reguladora responsável pela aprovação de dispositivos médicos no Japão. Os critérios de designação para inovação incluem o seguinte:
- Dispositivos com eficácia proeminente; espera-se que o dispositivo proporcione um benefício clínico significativo com um mecanismo de ação inovador e uma melhoria radical para os doentes em comparação com os dispositivos médicos existentes.
- Em primeiro lugar, o dispositivo é aplicável para aprovações no Japão ou simultaneamente no Japão e noutros países.
- O dispositivo tem o potencial de responder a necessidades médicas não satisfeitas no Japão. A condição médica alvo deve ser grave, ameaçadora da vida ou com sintomas persistentes.
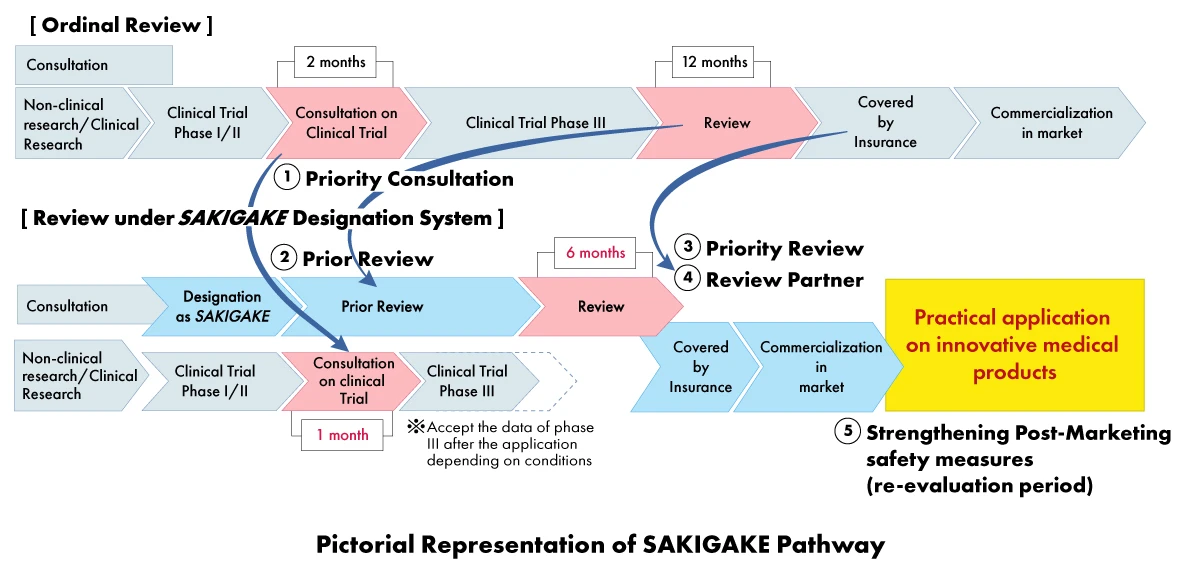
No âmbito da estratégia SAKIGAKE, os fabricantes de dispositivos médicos podem beneficiar de uma série de vantagens, nomeadamente
- Consulta prioritária: Redução do tempo de espera para consulta de ensaios clínicos para um (01) mês.
- Análise prioritária: Os produtos designados SAKIGAKE recebem uma análise prioritária, com o objetivo de concluir o processo de análise no prazo de seis (06) meses, em vez de 12 meses.
- Revisão eficaz antes da submissão: Incentivar a consulta e aceitar materiais em inglês.
- Parceiro de revisão dedicado: A cada produto designado pela SAKIGAKE é atribuído um gestor de revisão dedicado para todo o processo de aprovação.
- Reforço das medidas de segurança pós-comercialização: Prorrogação do período de reexame e facilitação da ligação com as sociedades científicas.
Como candidatar-se?
- Pelo requerente: O requerente está a apresentar a submissão Divisão PMDA e Licenciamento (ELD) PMDA .
- Por PMDA: A ELD está a aproximar-se de um potencial candidato.
P.C- PMDA, Japão.
De um modo geral, o sistema SAKIGAKE proporciona uma via acelerada para o desenvolvimento e a aprovação de dispositivos médicos inovadores no Japão. O seu objetivo é melhorar os resultados para os doentes e promover a inovação na indústria dos dispositivos médicos. O fabricante deve consultar a PMDA no início do processo de desenvolvimento para discutir os requisitos regulamentares e receber feedback sobre os seus planos de desenvolvimento de produtos.
Para descodificar mais sobre as vias de registo de dispositivos médicos no Japão, reach já um especialista em regulamentação! Mantenha-se informado. Mantenha-se em conformidade.