Shonin (Aprovação Pré-Comercialização) é o caminho regulatório para o registo de dispositivos médicos no Japão. O caminho Shonin é principalmente para o registo de dispositivos médicos de Classe II e III para os quais os padrões de classificação PMDAnão estão disponíveis. Para os dispositivos de Classe IV de alto risco, os fabricantes também devem apresentar o Shonin submissão. PMDA responsável pela análise e aprovação do Shonin submissão.
Quais são as outras vias de registo de dispositivos no Japão?
Para além do Shonin, as vias Todokede e Ninsho também são utilizadas para aprovações de dispositivos médicos no Japão. Os fabricantes de dispositivos médicos podem escolher uma delas, consoante a classe de risco do dispositivo e a disponibilidade de predicados no Japão. O fabricante deve identificar a classificação do dispositivo e pesquisar a disponibilidade da Norma Industrial Japonesa (JIS) antes de determinar a via de registo aplicável.
- Todokede (Apresentação antes da comercialização) - É aplicável aos dispositivos da classe I e exige que os fabricantes apresentem uma notificação antes da comercialização à PMDA para aprovação.
- Ninsho (Certificação Pré-Comercialização) - É aplicável a dispositivos genéricos de Classe II e III que possuem normas de certificação (Normas JIS). O Organismo de Certificação Registado (RCB) é responsável pela análise e aprovação da submissão.
Quais são os pré-requisitos para a inscrição no Shonin?
Os fabricantes que registam os seus dispositivos através da via Shonin devem planear meticulosamente as apresentações. Devem assegurar o seguinte:
- Apresentação de dados gerais sobre os dispositivos, como a categoria do dispositivo médico, a utilização prevista, os dados da análise de risco da eficácia, os dados clínicos, etc.
- Fornecimento de um resumo da documentação técnica (STED)
- Fornecimento de documentos apenas em japonês
- Os fabricantes estrangeiros devem obrigatoriamente nomear um Autorização de Introdução no Mercado (MAH) ou um Autorização de Introdução no Mercado Designado Autorização de Introdução no Mercado (DMAH).
- Os fabricantes estrangeiros devem obter um certificado de registo de fabricante estrangeiro (FMR) para os seus estabelecimentos de fabrico.
Quais são os requisitos do SGQ para o registo de dispositivos ao abrigo da via Shonin?
Os fabricantes devem cumprir todos os requisitos do SGQ definidos na Portaria 169. O promotor, o DMAH ou o MAH devem apresentar um pedido à PMDA. A PMDA efectua uma inspeção pormenorizada do SGQ das instalações do fabricante e emite o certificado após a implementação satisfatória do SGQ.
Qual é o processo de registo para a aprovação de dispositivos ao abrigo da via Shonin?
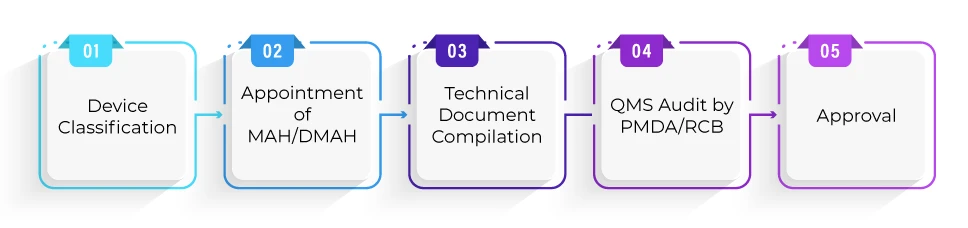
Qual é o prazo médio necessário para a aprovação de um dispositivo ao abrigo da via Shonin?
A PMDA requer 12 meses para a avaliação técnica a partir da data de recebimento da submissão Shonin. O fabricante deve considerar o tempo necessário para preparar os documentos de submissão ou realizar estudos clínicos nos cronogramas do projeto.
Existe algum prazo de validade para o registo de dispositivos ao abrigo da via Shonin?
O registo do dispositivo médico não expira, mas o promotor deve renovar os certificados do SGQ a cada cinco (05) anos.
O Japão é um mercado lucrativo, mas intrinsecamente associado a complexidades regulamentares e barreiras linguísticas. Os fabricantes devem considerar estes factores e planear proactivamente a sua estratégia de entrada no mercado (GTM) para o Japão. Os fabricantes de dispositivos médicos e IVD podem optar por subcontratar todas as nuances regulamentares a um parceiro regulamentar fiável e utilizar os recursos para se concentrarem noutros componentes essenciais.
Para saber mais sobre a aprovação de dispositivos médicos da Shonin no Japão ou qualquer outro regulamento PMDA Japão, contacte os especialistas em Regulamentaçãoda Freyr, hoje mesmo.