Visão geral dos serviços de conformidade com o IVDR da UE
O Regulamento Europeu de Diagnóstico In Vitro (RDIV UE) constitui uma nova base regulamentar para a colocação de dispositivos médicos de diagnóstico in vitro no mercado europeu. O Regulamento RDIV da UE deverá substituir a atual diretiva da UE relativa aos dispositivos médicos para diagnóstico in vitro (UE 98/79/CE). Sendo um regulamento europeu, entrará em vigor em todos os Member States da UE e nos Estados da Associação Europeia de Comércio Livre (EFTA) sem necessidade de ser transposto para a legislação dos respectivos Estados. Como parceiro regulamentar com provas dadas, Freyr fornece serviços de conformidade com o IVDR da UE e serviços de consultoria IVDR aos fabricantes para que estes cumpram os Regulamentos de Diagnóstico In Vitro e a marcação CE.
Marcar uma reunião com os nossos especialistas em IVDR da UE
O Regulamento IVDR - Cronograma de transição
Com entrada em vigor a partir de 26 de maio de 2022, o novo IVDR da UE é considerado uma mudança significativa na supervisão regulamentar dos IVD. Segue-se uma panorâmica da transição do IVDR
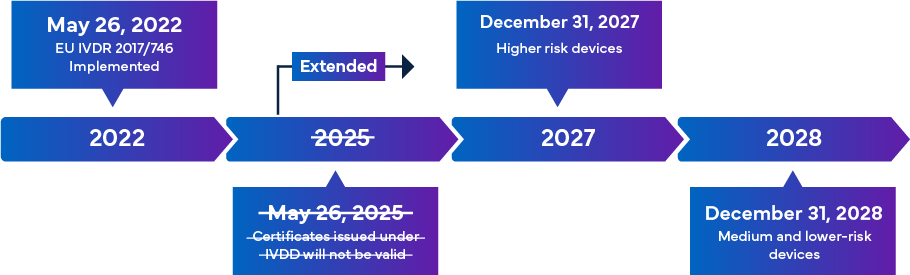
Uma vez totalmente implementadas, as regras de conformidade com o IVDR garantem que quase todos os IVDs que entram no mercado europeu estão sujeitos à análise do Organismo Notificado (NB) IVDR e à certificação da marcação CE como parte do Processo de Aprovação IVD. Neste cenário, para além do alinhamento com a classificação IVDR actualizada, existe um requisito imediato para que os fabricantes revejam eficazmente a documentação técnica fundamental para um registo IVD e uma marcação CE bem sucedidos. Os requisitos do IVDR variam consoante a classe de risco do IVD. Em geral, para a Certificação IVD, os fabricantes devem efetuar
- Revisões de ficheiros técnicos de acordo com o regulamento IVDR (Regulamento UE 2017/746)
- Preparação do Relatório de Avaliação do Desempenho (PER) para todos os IVDs
- Acompanhamento do desempenho pós-comercialização (PMPF), em conformidade com a parte B do anexo XIII do RIV
- Relatório de vigilância em conformidade com o artigo 82.º do RDIV
Freyr apoia os clientes na realização de uma revisão sistemática da literatura científica e ajuda no planeamento e preparação de um PER para o cumprimento do Regulamento de Diagnóstico In Vitro. Freyr tem especialistas dedicados who prestam serviços de consultoria IVDR e apoio Post-market Surveillance (PMS) , que é uma parte integrante do sistema de gestão da qualidade do fabricante, juntamente com o acompanhamento do desempenho pós-comercialização (PMPF).
Obtenha aconselhamento especializado sobre a conformidade com o IVDR da UE
Vantagens e competências dos serviços de conformidade com os IVDR da UE
- Plano de transição para o cumprimento do IVDR
- Revisão técnica e análise das lacunas dos requisitos dos IVDR para os GSPR (Requisitos Gerais de Segurança e Desempenho)
- Apoiar a compilação do dossier técnico de acordo com os requisitos do IVDR
- Relatórios de validade científica baseados na literatura e/ou em dados internos
- Relatórios de desempenho clínico baseados na literatura e/ou em dados internos
- Provas clínicas ou relatórios de avaliação do desempenho
- Protocolos e relatórios de acompanhamento do desempenho pós-comercialização (PMPF)
- Protocolos e relatórios de Post-market Surveillance (PMS)
- Redação/revisão de outros documentos, tais como o folheto informativo/IFU (instruções de utilização), instruções de consulta rápida (QRI), manual de funcionamento/utilizador, etc.

- Conformidade garantida com o IVDR, registo IVD e marcação CE
- Forte conhecimento da regulamentação e experiência nas principais áreas de impacto do IVDR da UE
- Forte modelo de entrega orientado para a gestão de projectos para garantir o cumprimento do calendário
- Peritos internos do NB (revisão do relatório pelos revisores interactivos do NB)
- Equipas especializadas com competências cruzadas em áreas de impacto específicas e categorias de dispositivos
- Contributos multifuncionais de especialistas em dispositivos médicos para cumprir os requisitos
- Âmbito completo do serviço em termos de conformidade, análise e planeamento
- Forte experiência na manutenção da coerência dos resultados (tempo e qualidade)





