
O desenvolvimento e a aprovação de medicamentos para crianças são um aspeto crítico dos cuidados de saúde pediátricos. No entanto, devido a considerações éticas e práticas, os ensaios clínicos envolvendo crianças são frequentemente limitados. Como resultado, a rotulagem de medicamentos pediátricos desempenha um papel crucial para garantir o uso seguro e adequado de medicamentos nesta população vulnerável. Neste blog, compararemos os requisitos de rotulagem de medicamentos pediátricos na União Europeia (UE) e nos Estados Unidos (US) para obter uma melhor compreensão das semelhanças e diferenças entre estas duas (02) estruturas regulatórias.
Requisitos de rotulagem pediátrica da UE
A UE tem requisitos específicos para a rotulagem pediátrica de Medicamentos. Esses requisitos garantem que os medicamentos destinados a crianças sejam devidamente testados, autorizados e rotulados para oferecer opções de tratamento seguras e eficazes para pacientes pediátricos.
Garanta a segurança dos medicamentos pediátricos. Entre em contacto Us
Garanta já a segurança dos medicamentos pediátricos
Eis alguns aspectos dos requisitos de rotulagem pediátrica da UE:
- Planos de Investigação Pediátrica (PIPs): Um PIP deve ser apresentado à Agência Europeia de Medicamentos (EMA) antes que um medicamento possa ser aprovado para crianças. Ele descreve os estudos e dados necessários para avaliar a segurança, eficácia e dosagem do medicamento em populações pediátricas.
- Autorização de Introdução no Mercado PUMA) para uso pediátrico: Se um medicamento tiver sido estudado em crianças e atender aos requisitos, ele poderá receber uma PUMA. Essa autorização permite que o medicamento seja comercializado para uso pediátrico.
- Formulações adequadas à idade: Os medicamentos para uso pediátrico devem estar disponíveis em formulações adequadas a diferentes grupos etários, tais como líquidos, comprimidos para mastigar ou dispositivos de dosagem adequados à idade.
- Resumo das Características do Medicamento (SmPC) específico para pediatria: O SmPC um documento que fornece informações detalhadas sobre um medicamento. Para produtos pediátricos, deve incluir detalhes específicos sobre dosagem, administração e considerações de segurança para diferentes faixas etárias.
- Advertências e precauções pediátricas: A rotulagem deve incluir quaisquer advertências ou precauções específicas relacionadas com a utilização do medicamento em crianças, tais como potenciais efeitos secundários ou interações com outros medicamentos habitualmente utilizados em doentes pediátricos.
- Monitorização e actualizações contínuas: Depois que um medicamento é aprovado para uso pediátrico, estudos pós-autorização podem ser necessários para reunir dados adicionais sobre sua segurança e eficácia. Estes podem levar a actualizações na rotulagem, conforme necessário.
Requisitos de rotulagem US
Nos US, a Food and Drug Administration (FDA) implementou a Lei de Equidade na Investigação Pediátrica (PREA) e a Lei dos Melhores Medicamentos para Crianças (BPCA) para promover a investigação e a rotulagem de medicamentos pediátricos. A PREA exige que as empresas farmacêuticas realizem estudos pediátricos para determinados medicamentos que possam ser utilizados em crianças. A BPCA concede seis (06) meses adicionais de exclusividade de mercado às empresas que realizam esses estudos.
A FDA diretrizes adicionais para garantir a segurança, eficácia e dosagem adequada dos medicamentos pediátricos, conforme segue:
- Planos de estudos pediátricos (PSPs): Os fabricantes devem apresentar planos que descrevam os estudos pediátricos para a avaliação da segurança e da eficácia dos medicamentos.
- Informação específica para a idade: Os rótulos devem incluir a dosagem específica para a idade, indicações e considerações de segurança.
- Doseamento com base no peso: As recomendações de dosagem em função do peso garantem uma administração exacta.
- Reacções adversas: Fornecer reacções adversas e dados de segurança específicos para crianças.
- Formulações específicas para uso pediátrico: Os medicamentos podem necessitar de formas de dosagem específicas para pediatria (por exemplo, líquidos e comprimidos para mastigar).
- Engenharia do fator humano: Os rótulos devem ter em conta a facilidade de administração para os prestadores de cuidados.
- Folhetos informativos para os doentes: São necessárias instruções claras sobre a administração, a dosagem e os efeitos secundários.
A tabela abaixo representa as diferenças e semelhanças entre os requisitos de rotulagem US da UE:
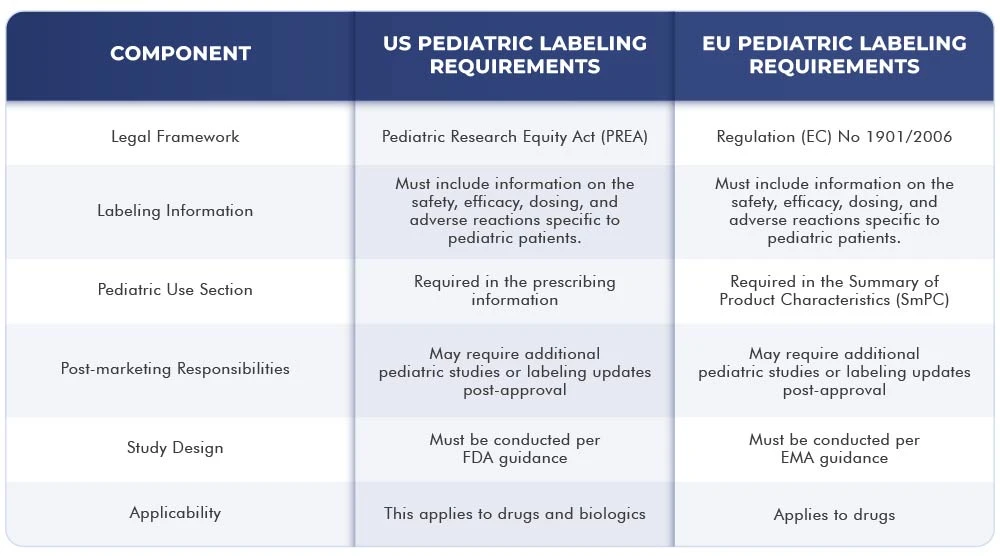
Conclusão
Os requisitos de rotulagem de medicamentos pediátricos na UE e US garantir o uso seguro e adequado de medicamentos em crianças. Embora existam semelhanças entre as duas estruturas regulatórias, como a necessidade de estudos pediátricos e a inclusão de informações específicas sobre pediatria na rotulagem dos medicamentos, também existem diferenças notáveis. Compreender essas semelhanças e diferenças é crucial para que as empresas farmacêuticas, os profissionais de saúde e os reguladores garantam que as crianças tenham acesso a medicamentos seguros e eficazes.
Consulte um especialista comprovado em rotulagem, como Freyr garantir a conformidade com os requisitos de rotulagem específicos de cada país.









