
Com a Administração US e Medicamentos US (USFDA) a implementar a regra final para os regulamentos do sistema de gestão da qualidade (QMSR) em 2024, os fabricantes de dispositivos médicos devem adotar as alterações para comercializar e distribuir os seus dispositivos no mercado dos EUA.
Esta regra atualiza os Regulamentos do Sistema de Qualidade (QSR) USFDA, alinhando-se com a ISO 13485:2016, que é a norma internacional para o SGQ de dispositivos médicos. Os fabricantes de dispositivos médicos têm um período de transição de dois anos para se adequarem, o que torna necessário que as organizações adaptem os novos requisitos para evitar a não conformidade no momento da inspeção.
O que é o QMSR?
FDA é uma abordagem simplificada aos requisitos do QMS, que é uma atualização da antiga estrutura do QSR. Esse alinhamento é crucial porque simplifica a conformidade global para os fabricantes, especialmente aqueles que operam globalmente. Essa harmonização permitirá que as empresas atendam aos requisitos regulatórios tanto nos US em outros mercados de uma maneira muito mais unificada.
O QMSR exige melhorias na gestão de riscos, no design dos dispositivos e Vigilância Pós-Comercialização. Esta função pode adicionar mais complexidade, mas também permite aos fabricantes padronizar os seus procedimentos de qualidade, o que, por sua vez, aumenta a segurança dos dispositivos e melhora a documentação, o que pode ser vital durante USFDA .
Principais alterações no QMSR
- Harmonização com ISO 13485: Esta é a etapa mais crítica, que permite aos fabricantes de dispositivos médicos aceitar normas internacionalmente reconhecidas. A USFDA que muitas empresas de dispositivos médicos já estão em conformidade com ISO 13485, o que reduz esforços duplicados.
- A Gestão de Riscos dá ênfase à gestão de riscos ao longo do ciclo de vida do dispositivo médico. Os fabricantes de dispositivos médicos devem demonstrar uma gestão de riscos eficaz, controlo de riscos e gestão de riscos.
- Concepção e controlos do dispositivo: Ao abrigo do QMSR, os controlos de concepção foram alargados para garantir que os fabricantes de dispositivos médicos tenham plenamente em conta as necessidades dos utilizadores, a segurança do dispositivo e os critérios de desempenho, que são uma área de foco durante USFDA .
- Vigilância Pós-Comercialização: As empresas precisam melhorar o sistema de monitoramento pós-comercialização. Isso exigirá que os fabricantes coletem informações sobre a segurança e a eficácia dos dispositivos, o que ajudará a identificar rapidamente os problemas.
- Documentação e manutenção de registos: Esta é a regra final que dá ênfase à documentação. A manutenção de registos completos/adequados é fundamental durante a inspeção.
Passos para se preparar para a inspeção da Administração US e Medicamentos US :
Com a inspeção a durar até 2026, as empresas dispõem de dois anos para os seus sistemas de qualidade que se alinham com o QMSR. No entanto, esperar pelo último minuto pode ser arriscado.
Etapas para USFDA sob a estrutura QMSR para indústrias cujo QMS atual não se baseia no QSR:
- Realizar uma análise de lacunas: Este é o primeiro passo, onde o sistema de qualidade atual diverge dos novos requisitos do QMSR. Uma análise completa das lacunas ajudará a identificar as áreas que precisam de atualizações, como gestão de riscos, Vigilância Pós-Comercialização controlos de design.
- Atualizar o procedimento de gestão de riscos: Certifique-se de que as atividades de gestão de riscos sejam combinadas com todo o ciclo de vida do seu produto, desde a concepção até Vigilância Pós-Comercialização.
- Revisitar o controlo da conceção: Os fabricantes devem garantir que o processo de conceção é sólido e bem documentado. Validar se o processo de conceção é sólido e bem documentado e se está totalmente integrado no seu sistema de gestão da qualidade.
- Melhorar Vigilância Pós-Comercialização: Implementar sistemas para monitorizar o desempenho do dispositivo após a sua colocação no mercado. Isso pode envolver a criação de mecanismos de feedback dos clientes, a recolha de evidências clínicas e o seu acompanhamento rigoroso.
- Formação e documentação: Formar os funcionários sobre os novos requisitos, especialmente aqueles que estão envolvidos na gestão da qualidade e conformidade regulamentar. Isso garante que todo o processo de documentação esteja alinhado com as expectativas do QMSR.
- Certificação por terceiros: Se a sua empresa não possui ISO 13485 , talvez seja o momento de considerar obtê-la. ISO 13485 pode proporcionar uma vantagem inicial no cumprimento dos requisitos da USFDA a credibilidade nos mercados globais.
Navegar no período de transição de dois anos
Para utilizar eficazmente o período de transição e garantir a conformidade com o Regulamento do Sistema de Gestão da Qualidade (QMSR) USFDA, os fabricantes devem adotar uma abordagem proativa. Aqui está um roteiro sugerido:
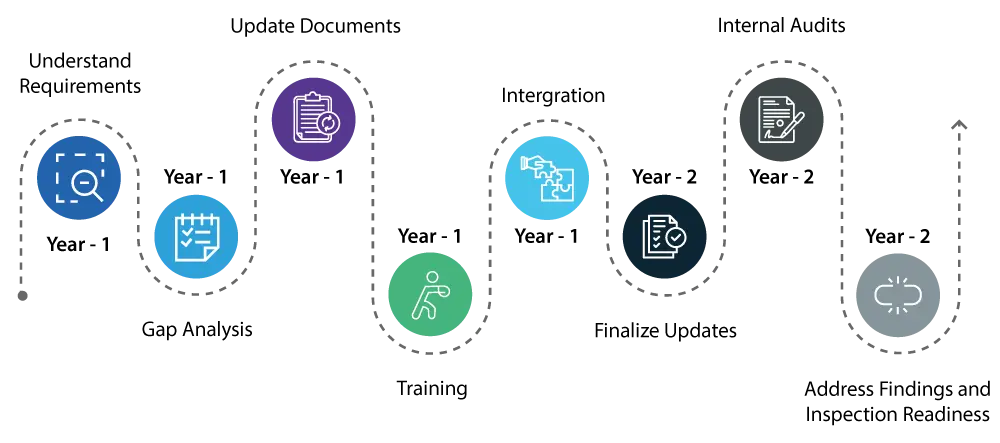
Ano 1:
- Compreender o requisito: Começar por compreender bem as alterações introduzidas pelo QMSR. Isto implica uma análise pormenorizada dos novos requisitos e da forma como diferem do atual Regulamento do Sistema de Qualidade (RQS).
- Conhecer as lacunas: Efectue uma análise exaustiva das lacunas para identificar as áreas do seu atual sistema de qualidade que necessitam de ser actualizadas para cumprir as novas normas QMSR.
- Atualização de documentos / correção: Inicie as actualizações necessárias ao seu sistema de qualidade, concentrando-se em áreas como a gestão de riscos e os controlos de conceção, que são componentes críticos do QMSR.
- Formação: Comece a formar o seu pessoal sobre os novos regulamentos para garantir que todos os envolvidos estão cientes das alterações e compreendem o seu papel na manutenção da conformidade.
- Integração: Comece a integrar os novos requisitos do QMSR nas suas operações diárias para tornar a transição mais suave.
Ano 2:
- Continuar com a implementação das alterações ao seu sistema de qualidade, assegurando que todas as actualizações estão totalmente integradas e operacionais.
- Realizar auditorias internas exaustivas para verificar se as actualizações são eficazes e se o seu sistema de qualidade está totalmente alinhado com os requisitos do QMSR.
- Abordar prontamente quaisquer conclusões das auditorias internas para garantir que todos os aspectos do seu sistema de qualidade estão em conformidade.
- No final do segundo ano, o seu sistema de qualidade deverá estar em total conformidade com o QMSR, e deverá estar preparado para USFDA com a confiança de que não haverá problemas significativos.
Seguindo este roteiro, os fabricantes podem não só cumprir os requisitos USFDA, mas também estabelecer um sistema de qualidade robusto que seja eficiente, padronizado e reconhecido globalmente. Esta abordagem proativa ajudará a garantir uma transição suave para as novas regulamentações e a manter os mais altos padrões de qualidade e segurança para dispositivos médicos.
Conclusão: Tomar medidas proactivas
A preparação para USFDA sob a nova regra QMSR não se resume apenas a evitar penalidades, mas também a melhorar a segurança e a eficácia dos dispositivos. Ao harmonizar-se com ISO 13485, a USFDA estabelecer expectativas mais elevadas, mas também a fornecer um caminho para uma conformidade global mais simplificada. Os fabricantes que começarem a adaptar-se antecipadamente devem concentrar-se em áreas-chave, como gestão de riscos e vigilância pós-comercialização, e garantir que os seus sistemas de qualidade estejam atualizados e sejam robustos, o que não só atenderá às expectativas regulatórias, mas também aumentará a sua vantagem competitiva no mercado.
