
O Conselho Internacional para a Harmonização dos Requisitos Técnicos para Produtos Farmacêuticos para Uso Humano (ICH) é uma organização internacional sem fins lucrativos que se esforça para manter uma base de dados atualizada para reunir agências reguladoras e fabricantes farmacêuticos para discutir aspectos científicos e técnicos da indústria numa única plataforma. O Dicionário Médico para Atividades Regulatórias (MedDRA), de propriedade e desenvolvido pelo ICH, é um dicionário regulatório distinto e padronizado que facilita a comunicação de informações regulatórias em todo o mundo, de forma integrada. Da mesma forma, pioneira em terminologia clínica, a Nomenclatura Sistemática de Medicina (SNOMED) Internacional é uma organização sem fins lucrativos que mantém a base de dados terminológica mais abrangente do mundo, a Nomenclatura Sistemática de Medicina - Termos Clínicos (SNOMED CT), que inclui mais de 350.000 conceitos que abrangem diagnósticos, sinais e sintomas.
Num estudo publicado em 2009, foi analisada a viabilidade de utilizar o SNOMED CT como ponto de entrada para codificar reações adversas a medicamentos e mapeá-las automaticamente para o MedDRA para fins de relatório e interoperabilidade com repositórios legados. Compreendendo o âmbito dessa colaboração, ICH o SNOMED, num esforço conjunto, anunciaram o lançamento de novos mapas importantes no espaço regulatório e clínico. Os esforços colaborativos no âmbito do projeto WEB-RADR 2 levaram ao lançamento de dois (02) importantes roteiros (MedDRA para SNOMED CT e SNOMED CT para MedDRA), que foram estruturados em torno da repetibilidade do uso de termos e termos adicionais de farmacovigilância MedDRA identificados pela Agência Europeia de Medicamentos (EMA). Para promover a segurança dos medicamentos, a interoperabilidade entre a base de dados de farmacovigilância (MedDRA) e os registos de saúde eletrónicos (SNOMED CT) pode ajudar a identificar possíveis efeitos secundários e ativar simultaneamente a notificação de eventos adversos. Os dados recolhidos através desses relatórios podem ser úteis para a realização de pesquisas epidemiológicas na demografia dos pacientes. Os elementos-chave associados à notificação de eventos adversos do MedDRA podem ser usados para associar eventos adversos de medicamentos, ao mesmo tempo que fornecem «ajuda na tomada de decisões clínicas».
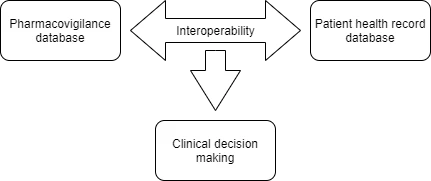
A versão de produção dos dois mapas está a ser disponibilizada aos utilizadores licenciados da SNOMED CT e da MedDRA a partir de 30 de abril de 2021 e basear-se-á na versão de janeiro de 2021 da SNOMED CT e na versão de setembro de 2020 da MedDRA. Foi decidido que os mapas serão lançados anualmente em abril.
Para aceder aos mapas:
- Utilizadores licenciados MedDRA, visitar a página Downloads no sítio Web MedDRA
- Os utilizadores licenciados do SNOMED CT visitam o SNOMED International
As atualizações recentes relativas à interoperabilidade estabelecida entre a base de dados de farmacovigilância e os registos de saúde dos pacientes podem parecer complexas de navegar. No entanto, os profissionais regulamentares experientes da Freyr podem funcionar como um único ponto de contacto para fornecer suporte técnico em toda a base de dados de saúde dos pacientes e necessidades aprimoradas de tomada de decisões clínicas. Para melhorar a qualidade dos resultados dos seus requisitos de farmacovigilância, oferecemos assistência em: ICSR, relatórios agregados, serviços Pessoa Qualificada pela PV (QPPV), serviços US , deteção e avaliação de sinais, migração de bases de dados, reconciliação de eventos adversos e serviços de afiliados locais, entre muitos outros. Para explorar a capacidade end-to-end da Freyr, contacte-nos agora! Mantenha-se informado. Mantenha-se em conformidade.









