Quando a pandemia da COVID-19 foi reconhecida pela primeira vez como uma crise de saúde global em 2020, as autoridades sanitárias globais (HAs) tomaram medidas inovadoras para lidar com ela da melhor maneira possível. Da mesma forma, as empresas farmacêuticas criaram váriasMedicamentos o benefício do público. No entanto, o registo dos produtos acabou por ser bastante desafiante. Para simplificar o registo, mantendo a sua segurança, qualidade e eficácia, as HA concederam Autorizações de Utilização de Emergência (EUAs) a algumas vacinas e produtos relevantes.
Pode colocar-se a questão de saber como é que as AS foram capazes de garantir que os benefícios dos referidos produtos superavam os riscos. A resposta é a adoção das melhores práticas de farmacovigilância (PV).
O que é a Farmacovigilância?
A PV é definida como um conjunto de actividades científicas relacionadas com a deteção, avaliação, compreensão e prevenção dos efeitos adversos e de quaisquer outros problemas relacionados com os medicamentos. Segue-se uma explicação figurativa do funcionamento da PV e do seu processo.
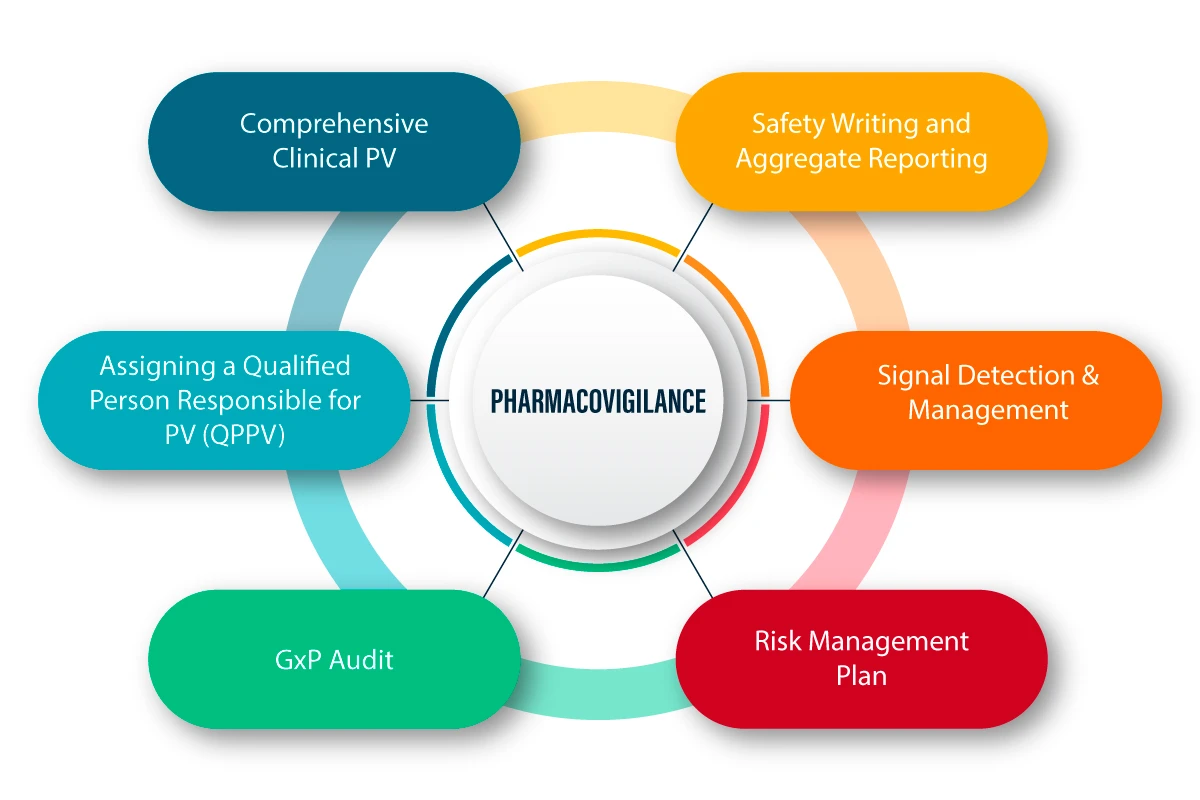
PV na pandemia de COVID-19
Quando a pandemia da COVID-19 começou a espalhar-se pelo mundo, as vacinas e Medicamentos relevantes Medicamentos de ser introduzidos no mercado num período limitado, mantendo os padrões de qualidade exigidos. Nesses cenários, havia menos indivíduos disponíveis para ensaios clínicos durante a fase de desenvolvimento de medicamentos/vacinas, e o processo teve de ser concluído mais rapidamente do que o normal. Isso poderia levar ao surgimento de certos efeitos adversos na fase pós-aprovação.
Portanto, o equilíbrio entre benefícios e riscosMedicamentos considerado fundamental. Com a comunicação oportuna de reações adversas e efeitos colaterais prejudiciais, a eficácia dos produtos foi mantida em tempo real.
Algumas das principais actividades de PV que ajudaram a manter a segurança, a qualidade e a eficácia dos referidos produtos durante a pandemia são as seguintes
- Adotar um bom Plano de Gestão de Risco
- Avaliação dos riscos com a ajuda dos relatórios periódicos actualizados de segurança (PSUR)
- Recolha dos dados de exposição
- Estudos de segurança pós-autorização (PASS)
- Notificação espontânea de suspeitas de reacções adversas
- Gestão eficaz dos sinais
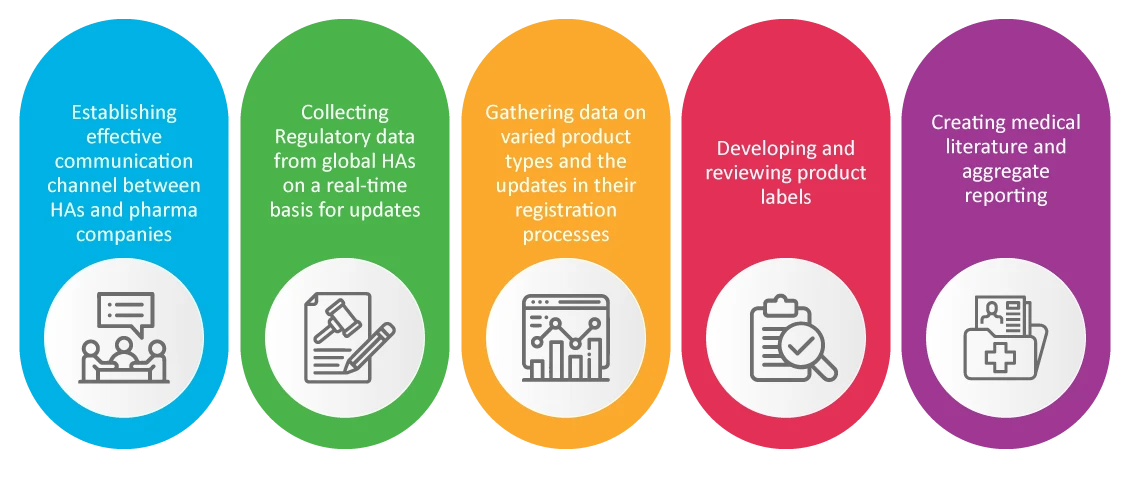
PV em Assuntos Regulamentares RA)
É sabido que a Assuntos Regulamentares de uma empresa farmacêutica é responsável pela segurança e aprovação de novos produtos. RA cuidam das atividades de farmacovigilância que se revelaram cruciais durante a pandemia, tais como:
Conclusão
Para concluir, o PV ajuda a monitorizar e relatar a segurança de um medicamento. Com Relatórios de Estudos de Casos Individuais (ICSR) personalizados, torna-se mais fácil para os fabricantes/patrocinadores cumprir as respetivas regulamentações das autoridades regulatórias globais. Procura apoio regulatório para a preparação de ICSR? Consulte um especialista regulatório comprovado para garantir a conformidade. Reach com Freyr.









