A publicidade direta ao consumidor (DTC) de medicamentos tornou-se um tema de discussão favorito nos últimos anos. Estes anúncios, que se destinam aos consumidores e não aos profissionais de saúde, foram considerados como tendo aumentado a sensibilização dos doentes e a procura de determinados medicamentos. No entanto, também têm sido criticados por poderem conduzir a um sobrediagnóstico e a um tratamento excessivo.
Participando da atual corrida de tendências dentro das empresas farmacêuticas, sabe-se que os gastos totais com marketing são superiores ao orçamento destinado à pesquisa. Globalmente, foram gastos US$ 1,42 trilhão em marketing. Nos EUA, foram gastos US$ 486,62 bilhões em 2021 para comercializar medicamentos para médicos; no Canadá, foram gastos US$ 29.305,1 milhões em 2022. Quando estes números foram detalhados, 56% eram amostras grátis, 25% eram representantes de vendas farmacêuticas «detalhando» (promovendo medicamentos diretamente a) médicos, 12,5% eram publicidade direta ao utilizador, 4% eram detalhando a hospitais e 2% eram anúncios em revistas2. Às vezes, práticas de marketing negativas podem afetar tanto os pacientes quanto os profissionais de saúde.
Tipos de acções de promoção de medicamentos
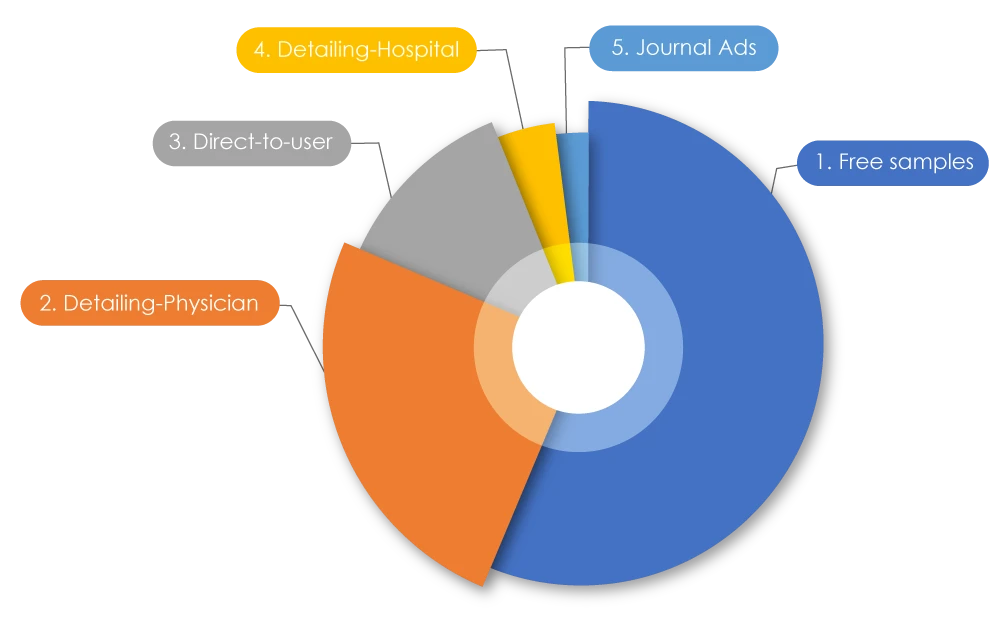
Fonte: Marketing farmacêutico - Wikiwand
Publicidade farmacêutica ao público em geral
São impostas restrições à publicidade a medicamentos sujeitos a receita médica junto do público em geral, também vulgarmente designada por publicidade direta ao consumidor (DTC). Para promover medicamentos sujeitos a receita médica junto do público, a comunicação deve cumprir determinados requisitos fundamentais:
- A consistência da publicidade e promoção de medicamentos sujeitos a receita médica com base nas indicações aprovadas depende da utilização prevista para a qual o produto foi aprovado pela FDA rotulagem do medicamento FDA). A rotulagem fornece informações sobre como utilizar o produto de forma segura e eficaz para a indicação aprovada. A publicidade e promoção que não estejam em conformidade com a rotulagem FDA são consideradas promoções ilegais «fora das indicações aprovadas».
- A promoção e a publicidade de medicamentos sujeitos a receita médica exigem um equilíbrio justo entre os benefícios e os riscos do produto, garantindo que essa informação seja comparável em termos de profundidade, pormenor e contexto
- As alegações devem ser apoiadas por provas adequadamente substanciais ou pela experiência clínica
- Verdadeiro e não enganoso - Se a publicidade e a promoção de medicamentos sujeitos a receita médica forem falsas ou enganosas em qualquer aspeto, serão consideradas de marca incorrecta ao abrigo da Lei Federal dos Alimentos, Medicamentos e Cosméticos (FDCA) e sujeitas a execução
- Utilização de uma linguagem acessível ao consumidor, evitando a utilização de linguagem técnica, termos científicos e jargão médico na publicidade e promoção dirigidas ao consumidor. Deve respeitar a rotulagem ou a monografia aprovada do produto
Informações contidas na publicidade farmacêutica destinada ao público em geral
A publicidade e promoção de medicamentos sujeitos a receita médica direcionadas ao consumidor devem conter os seguintes elementos essenciais, conforme exigido pelos regulamentos da FDCA e da Food and Drug Administration (FDA).
- Os nomes proprietários e estabelecidos devem ser conforme especificado nos FDA
- Deve incluir a quantidade quantitativa de ingredientes do medicamento anunciado
- Deve incluir um "breve resumo" que revele cada efeito secundário, aviso, precaução e contraindicação. Centra-se principalmente nas informações importantes sobre os riscos e não numa lista exaustiva dos riscos relacionados com o produto. A maioria dos riscos é apresentada de uma forma que seja mais suscetível de ser compreendida pelos consumidores
- Os principais riscos dos produtos devem ser apresentados de forma clara, visível e neutra como uma "Declaração principal"
- As declarações de divulgação de eventos adversos para anúncios DTC devem incluir a seguinte declaração MedWatch impressa em texto visível: «Recomenda-se que comunique os efeitos secundários negativos dos medicamentos sujeitos a receita médica à FDA. Visite fda ou ligue para +1–800-FDA-1088FDA
- A rotulagem e a publicidade de lembrança estão isentas dos requisitos gerais. É importante ressaltar que a rotulagem e a publicidade de lembrança não são permitidas para medicamentos sujeitos a receita médica com advertência em caixa na rotulagem FDA.
Para publicidade de medicamentos DTC, Us
Para a publicidade de medicamentos DTC
Restrições às interações entre doentes ou organizações de doentes e a indústria
As interações entre empresas farmacêuticas e doentes/organizações de doentes só são permitidas em alguns países, como os Estados Unidos, mas com limitações, como por exemplo
- Deve constar da rotulagem/CFL
- Equilibrado
- Adequadamente fundamentado e
- Não ser de outro modo falso ou enganador
Para além disso, as interações com os clientes não devem implicar o Estatuto Anti-Kickback ao induzir as organizações de doentes ou os doentes a recomendar ou utilizar o produto anunciado.
No Reino Unido, a publicidade DTC ao público é permitida para os produtos farmacêuticos, mas exclui as crianças. A publicidade ao público de medicamentos sujeitos a receita médica é proibida. Os anúncios devem incluir o nome do produto e o nome do ingrediente ativo. Não são permitidas amostras de produtos ou cupões que permitam aos consumidores obter o produto gratuitamente ou a um preço excessivamente baixo.
Na Alemanha, a publicidade ao público é permitida exclusivamente para medicamentos destinados a crianças com menos de 14 anos. A publicidade ao público de medicamentos sujeitos a receita médica é proibida. Mas também existem regras especiais para a publicidade de Medicamentos dos círculos profissionais. Essas regras especiais estão principalmente estabelecidas na Lei de Publicidade de Medicamentos (Heilmittelwerbegesetz, «HWG») e foram alteradas pela Lei Alemã sobre Produtos Farmacêuticos (Arzneimittelgesetz – «AMG») para estar em conformidade com a Diretiva 2001/83/CE4.
Debatendo a possibilidade da publicidade de medicamentos na Era digital
Os defensores da publicidade aos medicamentos no mercado livre argumentam que esta dá poder aos doentes, fornecendo-lhes informações sobre as opções de tratamento. Salientam também que pode levar a um aumento da procura de medicamentos, o que pode ser benéfico para as empresas farmacêuticas.
Por outro lado, os críticos da publicidade aos medicamentos no mercado livre argumentam que esta pode conduzir a um sobrediagnóstico e a um tratamento excessivo. Afirmam que, muitas vezes, estes anúncios exageram os benefícios dos medicamentos e minimizam os seus riscos, levando os doentes a pedir aos seus médicos medicamentos de que podem não precisar. Além disso, afirmam que pode levar a um aumento dos custos dos cuidados de saúde, uma vez que podem ser prescritos aos doentes medicamentos de marca mais caros em vez de alternativas genéricas mais baratas.
Apesar do debate em curso, a publicidade direta ao consumidor de medicamentos veio para ficar. A FDA diretrizes para este subtipo de publicidade, que incluem requisitos para a divulgação de riscos e um equilíbrio justo entre benefícios e riscos. Em conclusão, a publicidade direta ao consumidor de medicamentos tem o potencial de educar os pacientes e aumentar a procura por determinados medicamentos. No entanto, também é importante considerar as potenciais desvantagens e estar ciente das limitações das informações fornecidas nessas propagandas. Como sempre, é importante consultar o seu médico antes de tomar qualquer medicamento. Reach com os especialistas da Freyr para obter end-to-end !