
A intercambiabilidade com um produto biológico de referência é uma etapa crucial no processo de aprovação de biossimilares. Ela garante que um biossimilar possa substituir o produto de referência sem qualquer risco significativo de redução da eficácia ou aumento das preocupações com a segurança. Este blog procura compreender as últimas FDA sobre as considerações para alcançar a intercambiabilidade e as melhores práticas do setor para alcançar a excelência regulatória.
Definição de permutabilidade
A obtenção da intercambialidade é um processo complexo e rigoroso que exige o cumprimento de requisitos regulamentares rigorosos. O desafio consiste em demonstrar que o biossimilar não só corresponde ao produto de referência em termos de segurança e eficácia mas também fornece os mesmos resultados clínicos num determinado doente. O não cumprimento destes requisitos pode resultar em atrasos ou recusas na aprovação, afectando o acesso ao mercado e os cuidados dos doentes.
Requisitos regulamentares para a permutabilidade
A FDA critérios específicos para demonstrar a intercambiabilidade nos seus documentos de orientação. Esses critérios incluem:
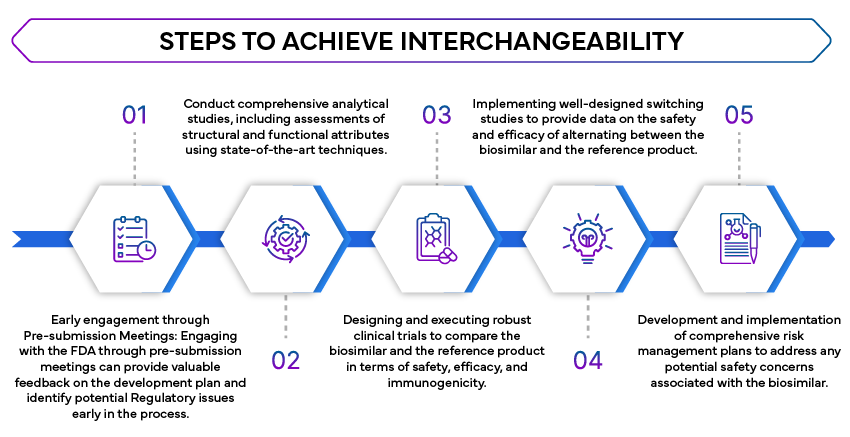
- Estudos analíticos comparativos: São necessários estudos analíticos extensos para demonstrar que o biossimilar é altamente semelhante ao produto de referência. Esses estudos avaliam a estrutura molecular, a função e a composição do biossimilar.
- Estudos clínicos: São necessários estudos clínicos para confirmar que o biossimilar não apresenta diferenças clinicamente significativas em relação ao produto de referência em termos de segurança, pureza e potência. Isto envolve frequentemente estudos comparativos de farmacocinética (PK) e farmacodinâmica (PD).
- Estudos de troca: A FDA estudos de troca para avaliar o impacto da alternância entre o biossimilar e o produto de referência. Esses estudos são cruciais para garantir que a troca não afete a eficácia ou a segurança do tratamento.
- Estratégias de Avaliação e Mitigação de Riscos (REMS): Se aplicável, as REMS devem ser abordadas para garantir que o biossimilar pode ser utilizado indistintamente sem preocupações adicionais de segurança.
Passos para alcançar a permutabilidade de forma estratégica
Papel de um parceiro regulador
As parcerias regulamentares podem aumentar significativamente a probabilidade de alcançar a permutabilidade. Eis como um parceiro regulamentar pode ajudar:
- Orientação especializada: Fornece consultoria especializada sobre requisitos regulamentares e estratégias para cumprir FDA .
- Apoio à documentação: Ajuda na preparação de documentos de apresentação de alta qualidade que cumprem as normas regulamentares.
- Conceção de estudos clínicos: Apoia a conceção e execução de estudos clínicos e de comutação sólidos.
- Interações com o HA: Facilita a comunicação efectiva com a HA, assegurando um feedback atempado e construtivo.
- Gestão de riscos: Desenvolver estratégias abrangentes de gestão de riscos para mitigar potenciais preocupações de segurança.
Vantagens de ter um parceiro de regulamentação
| Vantagens | Descrição | |
| 1. | Experiência em requisitos regulamentares | Conhecimento profundo dos cenários e requisitos regulamentares globais. |
| 2. | Documentação simplificada | Assegura a preparação de documentação exacta e conforme. |
| 3. | Processo de apresentação eficiente | Reduz o tempo e os custos através de uma gestão eficiente das submissões. |
| 4. | Conformidade reforçada | Minimiza o risco de atrasos e rejeições através de uma conformidade rigorosa. |
| 5. | Gestão eficaz dos riscos | Identificação proactiva e atenuação de riscos potenciais. |
Resumo
Conseguir a permutabilidade com um produto de referência é um processo exigente mas essencial para a aprovação bem sucedida de biossimilares. Requer uma compreensão abrangente dos requisitos regulamentares, um planeamento meticuloso e dados clínicos sólidos. A parceria com um provedor de serviços regulatórios experiente pode aumentar muito as chances de sucesso, garantindo que o biossimilar atenda aos critérios rigorosos estabelecidos pelas autoridades regulatórias. Ao aproveitar a orientação de especialistas, a documentação completa e o gerenciamento estratégico de riscos, os patrocinadores podem navegar pelo complexo caminho da intercambialidade com mais eficiência.









