
Nos últimos anos, o panorama dos Assuntos Regulamentares uma transformação significativa. No centro dessa mudança está uma ênfase crescente na centralidade do pacientepaciente, com as autoridades sanitárias (HA) em todo o mundo a reconhecerem o papel inestimável que os pacientes desempenham no desenvolvimento e aprovação de novos Medicamentos. Esta mudança não é apenas uma tendência; é uma reformulação fundamental da forma como abordamos os pedidos de regulamentação e, em última análise, como servimos aqueles que mais importam – os pacientes.
O problema:
Tradicionalmente, os pedidos de aprovação regulamentar concentravam-se principalmente no cumprimento de requisitos técnicos e científicos, muitas vezes ignorando o impacto direto nas experiências e resultados dos pacientes. Essa abordagem, embora completa, às vezes não consegue captar as nuances das necessidades e preferências dos pacientes, bem como o uso real dos Medicamentos. Como resultado, havia uma desconexão entre as aprovações regulamentares e o valor real entregue aos pacientes.
Abordagens regulamentares centradas no doente:
As autoridades sanitárias, particularmente a FDA EMA, deram passos significativos na incorporação das perspetivas dos pacientes nas suas estruturas regulatórias.
Esta abordagem que coloca o doente em primeiro lugar é evidente em vários domínios fundamentais:
- Desenvolvimento de medicamentos focado no paciente (PFDD):
O programa PFDD FDA é uma iniciativa inovadora que reúne sistematicamente as opiniões dos pacientes para informar o desenvolvimento de medicamentos e a tomada de decisões regulatórias. Este programa inclui sessões de escuta dos pacientes, reuniões públicas e o desenvolvimento de documentos de orientação para aumentar o envolvimento dos pacientes ao longo do ciclo de vida do produto. - Evidência do mundo real (RWE):
Há um reconhecimento crescente do valor dos dados do mundo real para compreender o desempenho de um produto em diversas populações de pacientes. As HAs estão agora mais abertas a considerar a RWE nas submissões regulamentares, fornecendo uma visão mais abrangente dos benefícios e riscos de um produto. - Resultados relatados pelos pacientes (PROs):
A inclusão de PROs nos ensaios clínicos e nas submissões regulamentares tem-se tornado cada vez mais importante. Estas medidas captam diretamente a experiência do doente, fornecendo informações valiosas sobre os sintomas, a qualidade de vida e a satisfação com o tratamento. - Envolvimento precoce e aconselhamento científico:
As autoridades de saúde estão a incentivar os promotores a envolverem-se desde o início do processo de desenvolvimento, incluindo frequentemente representantes dos doentes nestas discussões. Este diálogo precoce ajuda a alinhar os planos de desenvolvimento com as necessidades dos doentes e as expectativas da regulamentação. - Envolvimento do paciente nas avaliações de risco-benefício:
Tanto a FDA EMA estruturas para incorporar as perspectivas dos pacientes nas avaliações de risco-benefício, garantindo que as decisões regulatórias reflitam o que é mais importante para os pacientes.
Tabela: Principais iniciativas centradas no doente das principais autoridades de saúde
| Autoridade sanitária | Iniciativa | Descrição |
|---|---|---|
| FDA | Desenvolvimento de medicamentos centrado no doente (PFDD) | Abordagem sistemática da recolha de contributos dos doentes |
| EMA | Grupo de Trabalho dos Doentes e Consumidores (PCWP) | Fórum para o diálogo com as organizações de doentes e de consumidores |
| MHRA | Envolvimento dos doentes e do público | Estratégia para envolver os doentes nos processos regulamentares |
| Health Canada | Quadro de envolvimento dos medicamentos e produtos de saúde canadianos | Aumenta a participação dos doentes nas actividades de regulamentação |
Papel dos prestadores de serviços de regulamentação:
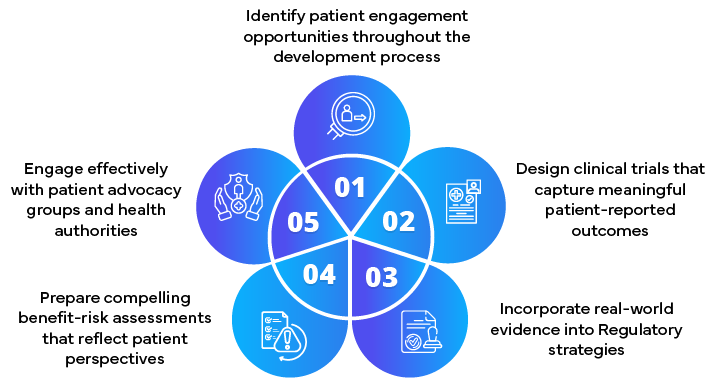
Neste cenário em evolução, o papel dos Assuntos Regulamentares e parceiros Assuntos Regulamentares tornou-se mais crucial do que nunca. Eles atuam como ponte entre patrocinadores, autoridades sanitárias e pacientes, garantindo que as estratégias regulatórias estejam alinhadas com abordagens centradas no paciente.
As principais responsabilidades incluem:
- Desenvolver estratégias de envolvimento dos doentes
- Incorporar a contribuição dos doentes nas apresentações regulamentares
- Aconselhamento sobre a recolha e apresentação de dados centrados no doente
- Facilitar a colaboração precoce com as autoridades de saúde
- Manter-se a par da evolução dos requisitos regulamentares centrados nos doentes
Papel dos parceiros reguladores na obtenção de apresentações centradas no doente
Resumo:
A mudança para uma abordagem centrada no paciente em Assuntos Regulamentares uma oportunidade significativa para desenvolver e aprovar produtos médicos que realmente atendam às necessidades dos pacientes. Ao adotar essa abordagem, os patrocinadores podem não apenas navegar pelos caminhos regulatórios de forma mais eficaz, mas também fornecer produtos que fazem uma diferença significativa na vida dos pacientes. À medida que as autoridades de saúde continuam a refinar as suas abordagens centradas no paciente, a experiência dos prestadores de serviços regulatórios ou parceiros torna-se inestimável para garantir que as submissões não apenas atendam aos requisitos técnicos, mas também reflitam as experiências e prioridades dos pacientes.
Nesta nova era Assuntos Regulamentares, colocar os pacientes em primeiro lugar não é apenas uma boa prática – é a chave para o sucesso.









