
A gestão das alterações pós-aprovação é um aspeto essencial, mas frequentemente negligenciado, da gestão do ciclo de vida dos produtos farmacêuticos. Após a aprovação de um medicamento, este deve continuar a cumprir as normas regulamentares para garantir a sua segurança, eficácia e qualidade. Isto implica efetuar as alterações necessárias ao produto, ao seu processo de fabrico ou à sua embalagem.
Estas alterações vão muitas vezes desde a melhoria da eficiência da produção, à resolução de questões de segurança ou ao cumprimento dos mais recentes e/ou novos requisitos regulamentares. No entanto, a gestão destas alterações apresenta vários desafios ocultos que podem afetar o ciclo de vida do produto e a sua presença no mercado. Neste tipo de esforço, é necessária a presença de um parceiro regulamentar para analisar a gestão deste processo de mudança e conduzir as operações regulamentares sem problemas.
Obstáculos para uma empresa farmacêutica
A navegação pelas alterações pós-aprovação segue complexidades que afectam significativamente as diferentes regiões, criando obstáculos à conformidade. Além disso, garantir a integridade dos dados, coordenar várias partes interessadase gestão de documentação extensa pode ser assustador. A incapacidade de gerir eficazmente estes aspectos pode resultar em não-conformidade regulamentar, recolhas de produtos e graves danos operacionais e de reputação.
Alguns desafios na realização da gestão das alterações pós-aprovação
- Complexidade regulamentar
- As diferentes autoridades de saúde (AS) em todo o mundo têm requisitos únicos para alterações pós-aprovação que exigem um conhecimento profundo das diretrizes e dos prazos específicos de cada região. Compreender estas diferenças é crucial para que as apresentações sejam atempadas e bem sucedidas.
- Os atrasos na compreensão destes regulamentos podem levar a retrocessos significativos no ciclo de vida do produto.
- Integridade dos dados
- É fundamental garantir a exatidão e a integridade dos dados apresentados para alterações pós-aprovação. Dados inexactos ou incompletos podem levar a rejeições regulamentares e a atrasos significativos.
- A manutenção de elevados padrões de qualidade dos dados implica processos de validação rigorosos e auditorias frequentes para evitar discrepâncias.
- Coordenação das partes interessadas
- Uma gestão eficaz das alterações pós-aprovação envolve a coordenação entre equipas internas (como I&D, fabrico e garantia de qualidade) e parceiros externos (como organizações de fabrico por contrato).
- A utilização de ferramentas de gestão de projectos e a realização regular de reuniões multifuncionais podem melhorar a colaboração e garantir que todas as partes estão alinhadas.
- Documentação
- Uma documentação pormenorizada e precisa é crucial para demonstrar a conformidade e facilitar os processos de revisão.
- Pelo contrário, as más práticas de documentação podem levar a consultas regulamentares, pedidos de dados adicionais e atrasos na apresentação.
- Gestão do risco
- A gestão proactiva dos riscos ajuda a antecipar os desafios e a implementar soluções para manter o processo de apresentação no bom caminho.
- Um Plano de Gestão de Risco eficaz Plano de Gestão de Risco a probabilidade de contratempos regulatórios e garante a conformidade contínua.
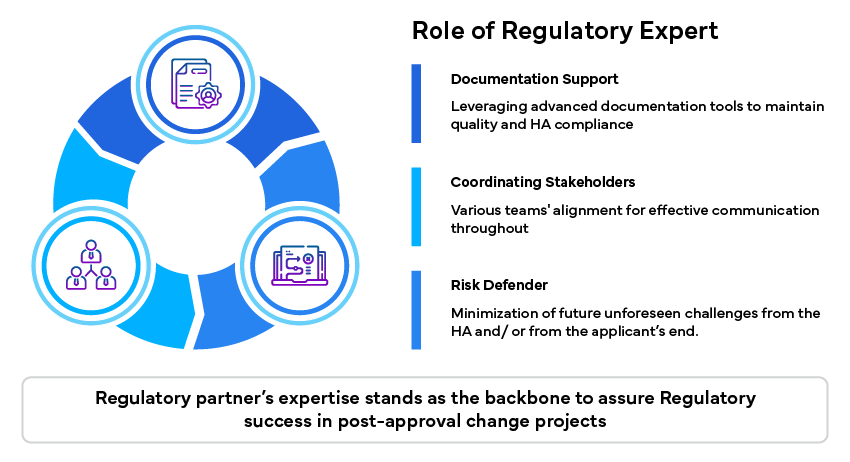
Papel do perito em regulamentação
Os peritos em regulamentação desempenham um papel importante na superação destes desafios, fornecendo conhecimentos especializados e apoio:
Resumo
A gestão eficaz das alterações pós-aprovação é essencial para manter a qualidade, a segurança e a eficácia dos medicamentos farmacêuticos. É necessário navegar pelas complexidades regulamentares para obter as aprovações de gestão de alterações da AS. Os especialistas em regulamentação fornecem um apoio inestimável para ultrapassar estes desafios, oferecendo os seus conhecimentos, facilitando a coordenação e atenuando os riscos. Ao tirar partido das suas capacidades, os requerentes podem garantir o êxito da gestão de alterações pós-aprovação e manter a presença dos seus produtos no mercado.









