
Wussten Sie schon? Man kann in den kommenden drei (03) Jahren bis zu einer Million einsparen, wenn man anstelle des bestehenden Modells der Computersystemvalidierung (CSV) die Computersoftware-Assurance (CSA) einführt!
Im Laufe der Jahre haben Pharmaunternehmen CSV, einen risikobasierten Validierungsansatz, eingeführt, um sicherzustellen, dass die Computerbetriebssysteme den gesetzlichen Anforderungen entsprechen.
Da sich die Branche nun auf die nächste Umstellung (neben einem risikobasierten Ansatz) vorbereitet, nämlich CSA, USFDA für 2022 die Veröffentlichung neuer Leitlinien zu CSA, um Unternehmen dabei zu helfen, die Produktqualität und die Einhaltung gesetzlicher Vorschriften zu verstehen. Die Leitlinien sollen ein klares Verständnis dafür vermitteln, wie, wo und welche Maßnahmen ergriffen werden müssen, um eine erfolgreiche Software-Risikobewertung durchzuführen.
Lassen Sie uns nun den Vergleich zwischen CSV und CSA aus prozessualer, personeller und technologischer Sicht erörtern und erörtern, wie eine erfolgreiche Implementierung von CSA einem Unternehmen greifbare Vorteile bringen kann.
Prozess
Die Validierung von Computersystemen (CSV) ist ein auf die Einhaltung von Vorschriften ausgerichteter dokumentierter Ansatz, der als Nachweis dafür dient, dass das System für den vorgesehenen Zweck geeignet ist.
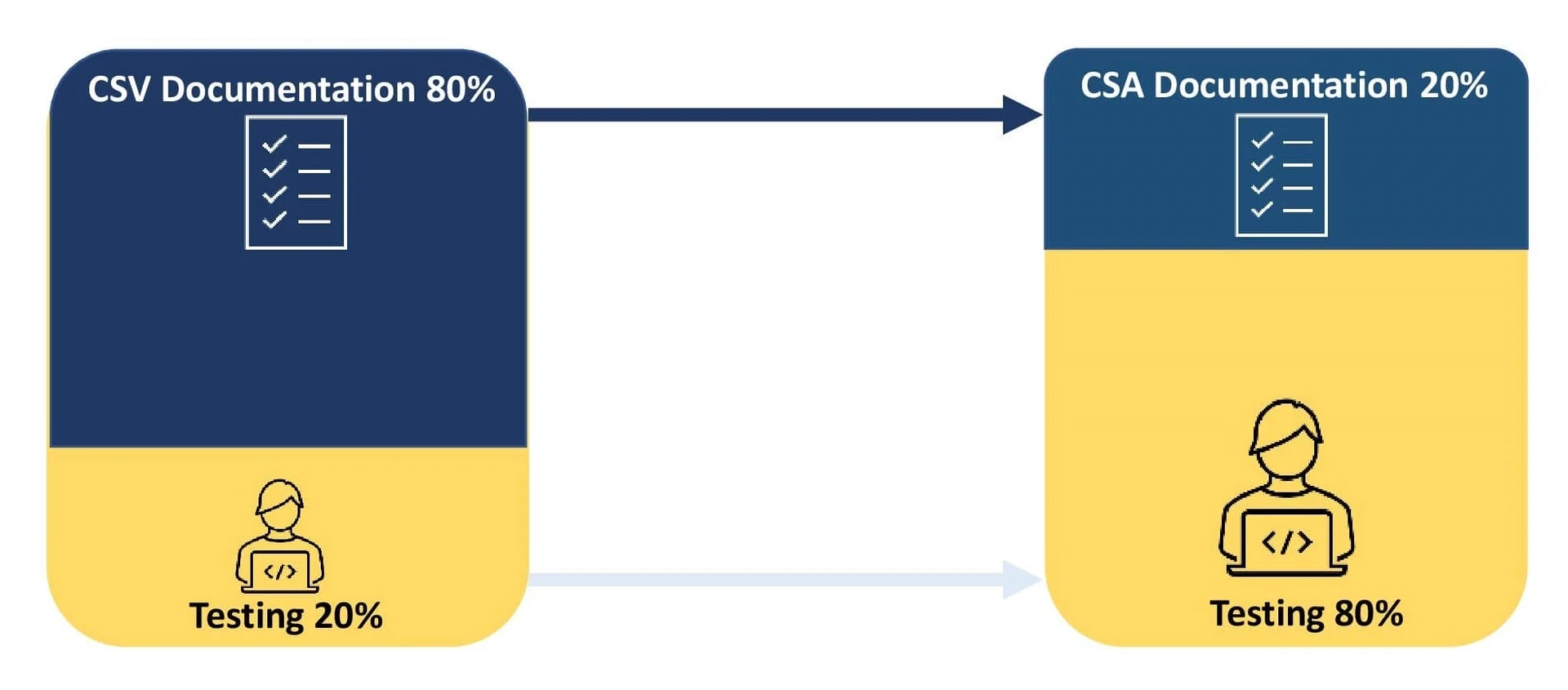
Ein Unternehmen investiert 80 % seines Aufwands in die Dokumentation des Validierungsprozesses und 20 % in die Tests. Jede Abweichung bei den CSV-Tests in Verbindung mit den erwarteten Ergebnissen muss dokumentiert und ein Plan für Abhilfemaßnahmen umgesetzt werden.
Computer Software Assurance (CSA) ist ein qualitätsorientierter Ansatz, der die Auswirkungen von Softwaresystemen auf die Sicherheit der Patienten, die Produktqualität und die Datenintegrität betont.
Das Hauptziel besteht darin, sich auf die Validierung und Dokumentation von sicherheitsgefährdenden Aktivitäten auf der Grundlage der Softwarekomplexität zu konzentrieren. Ein solcher Ansatz fördert den Einsatz von Digitalisierung und Automatisierung und verbessert so die Produktqualität. Die Verkürzung des Dokumentationsprozesses hilft Unternehmen, auf kritische Softwareprobleme zu reagieren und die Vorgaben der Gesundheitsbehörden einzuhalten. CSA nutzt die Qualitätssicherungssysteme der Anbieter für ungeschriebene Tests zur Validierung von Systemen mit geringem Risiko, so dass die Unternehmen 80 % ihres Aufwands in Tests und 20 % in die Dokumentation investieren können.
Daher sollten Prozesse angepasst (geändert) werden, um den CSA-Ansatz in verschiedenen Phasen des SDLC widerzuspiegeln. Dies kann erreicht werden durch:
- Quality by Design (QbD) – Durch die Priorisierung der Patientensicherheit und Produktqualität wird sichergestellt, dass das primäre Ziel des installierten Softwaresystems darin besteht, die Anforderungen der Benutzer zur Optimierung der Produktqualität zu erfüllen.
- Die risikobasierte Validierungsstrategie erfordert eine sorgfältige Prüfung und Dokumentation von Systemen, die bei direkten Risiken fehleranfällig sind, und weniger bei indirekten oder risikofreien Fällen.
- Ein Umdenken in Bezug auf das Verhältnis zwischen Dokumenten und Tests ermöglicht es den Sponsoren, ihren Validierungsprozess neu zu definieren, indem sie aufgefordert werden, 80 % des Aufwands für Tests und 20 % für die Dokumentation aufzuwenden.
- Erzielung greifbarer Vorteile durch die Verringerung des Dokumentationsdrucks.
Menschen
Das Unterscheidungsmerkmal zwischen CSV und CSA liegt in der Hierarchie der Strategie. Bei der CSV steht die Dokumentation im Vordergrund, gefolgt von Tests und kritischem Denken, während bei der CSA kritisches Denken der erste Schritt ist, gefolgt von Tests und Dokumentation. Bei der CSV wird der dokumentierte Nachweis erbracht, dass ein computergestütztes System die Tätigkeiten gemäß den vorab vereinbarten Spezifikationen und Qualitätsmerkmalen durchführt und effizient und effektiv ist. Auf der anderen Seite empfiehlt CSA dem Auftraggeber Prozessverbesserungen, um Risiken und mögliche Fehler zu minimieren.
Erweitern Sie auf der Führungsebene das Spektrum des kritischen Denkens, indem Sie mehrere Möglichkeiten haben, mit unsicheren Situationen umzugehen, denn es gibt nicht den "einen" richtigen Weg, um etwas zu erreichen. Kritisches Denken öffnet Türen für Innovationen zur Entwicklung zuverlässiger Produkte.
Auf der Ebene der Praxis und der Anwendung müssen die Mitarbeiter geschult und darauf vorbereitet werden, sich durch effektive Zusammenarbeit und wirksame Schulungsprogramme auf CSA umzustellen und anzupassen.
Technologie-Perspektive
Umfassende Leitlinien zu CSV gibt es bereits von Aufsichtsbehörden wie USFDA, EMA, MHRA und vielen anderen. Brauchen wir also CSA? Die Antwort lautet ja. CSA wird das Ziel der Validierung in den richtigen Kontext stellen und die Diskrepanz zwischen Sponsoren und Gesundheitsbehörden beseitigen. Es gibt angemessene Vorschriften und Branchenleitlinien, die Pharmaunternehmen verstehen müssen, um durch eine Vereinfachung des Validierungsprozesses geschäftliche Vorteile zu erzielen. Der Übergang von der traditionellen CSV zur CSA verlagert die Priorität des Unternehmens von der Erfüllung der regulatorischen Compliance-Anforderungen hin zu Produktqualität und -sicherheit. Eine solche Verlagerung maximiert die Wirkung des Validierungsprozesses, indem sie den umfangreichen Dokumentationsaufwand, den Projektzeitplan und die Kosten für Life-Science-Unternehmen reduziert.
Sowohl auf strategischer als auch auf operativer Ebene kann dies durch die Förderung der Digitalisierung und Automatisierung erreicht werden, wodurch alle möglichen Risiken und menschlichen Fehler gemindert werden.
Schlussfolgerung
Da die LeitlinienFDA US FDAzu CSA noch nicht veröffentlicht wurden, sollten Pharmaunternehmen proaktiv damit beginnen, über den Übergang von CSV zu CSA nachzudenken und entsprechende Protokolle auszuarbeiten. Die Unternehmen müssen:
- Neubewertung und Identifizierung von Systemen, die sich direkt und indirekt auf die Patientensicherheit, Produktqualität und Datenintegrität auswirken.
- Zuweisung von Ressourcen, die einen reibungslosen Übergang des Validierungsprozesses gewährleisten können.
- Durchführung einer Lückenanalyse im Vergleich zum bestehenden System, um etwaige Diskrepanzen zu ermitteln.
Die Bewertung des Validierungsansatzes gibt Aufschluss darüber, was eine Organisation tun kann, um Änderungen vorzunehmen, wenn sie auf ein Systemproblem stößt. Die ordnungsgemäße Durchführung des CSV-Prozesses erfordert ein tiefgreifendes Verständnis des Systems und Erkenntnisse über die Möglichkeiten seiner Nutzung.
Für Unternehmen ist es derzeit unerlässlich, mit CSV-Experten zusammenzuarbeiten, die einfache bis komplexe Projekte moderieren und einen reibungslosen Übergang von CSV zu CSA unterstützen können. Ein Rahmenwerk zur Qualitätsprüfung minimiert Nacharbeiten im Produkt- und Lieferantenvalidierungsprozess, um vollständige Compliance und Validierung in jeder Phase der Bereitstellung, Wartung und Außerbetriebnahme zu einem äußerst wettbewerbsfähigen Preis zu gewährleisten. Reach Freyr Compliance-Fragen an Freyr .









