Überblick über die Post-Market Surveillance
Post-market surveillance (PMS) für Hersteller von Medizinprodukten und andere Unternehmen, die am Vertrieb von Produkten beteiligt sind, von entscheidender Bedeutung, um die Patientensicherheit, die Einhaltung der Vorschriften für Medizinprodukte, die kontinuierliche Produktverbesserung und die Gewährleistung der Sicherheit, Wirksamkeit und Konformität von Medizinprodukten nach ihrem Inverkehrbringen sicherzustellen.
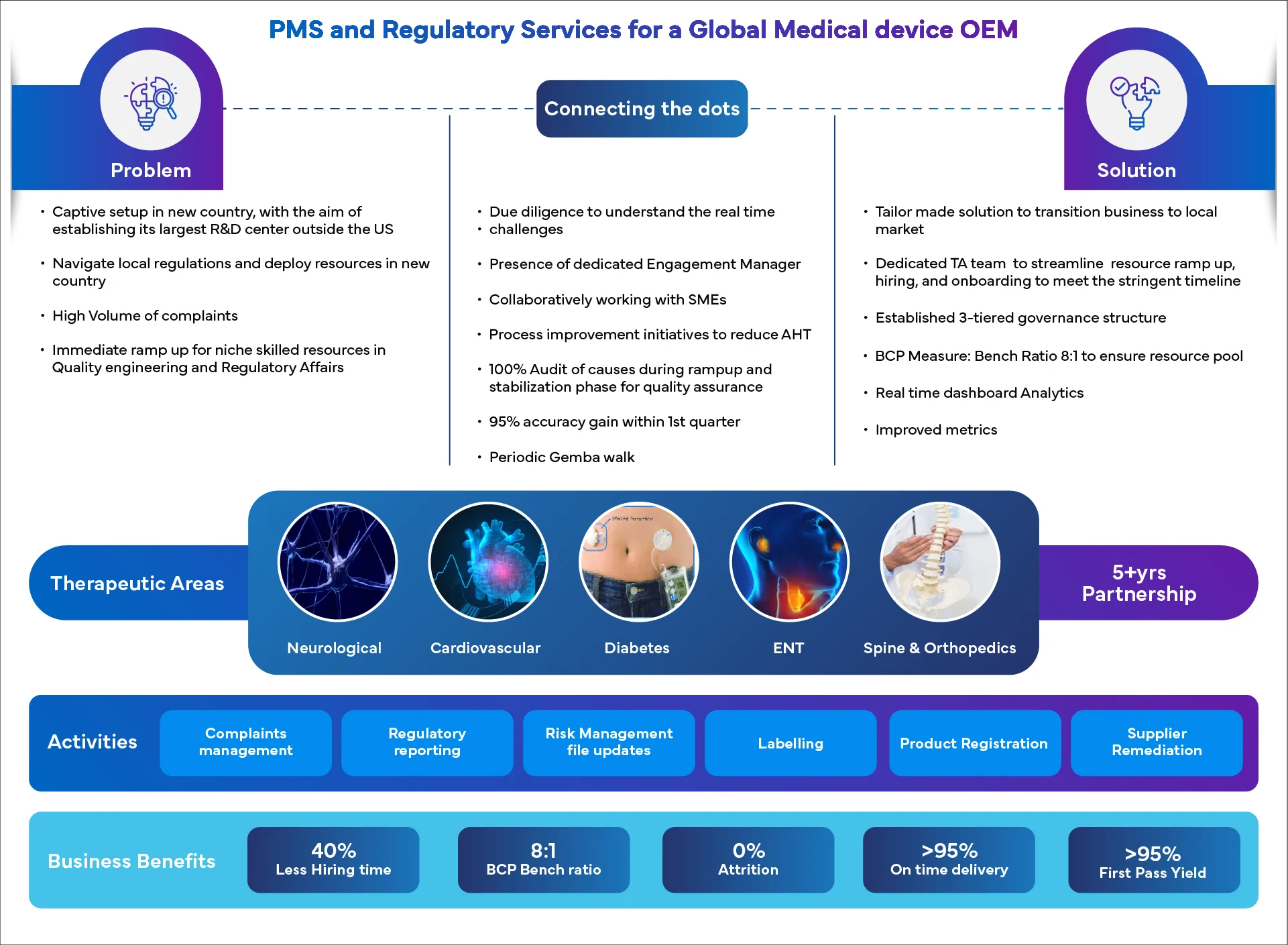
Die Berater von Freyrfür die Überwachung nach dem Inverkehrbringen helfen Herstellern von Medizinprodukten bei der Bewältigung der komplexen Vorschriften für die Überwachung nach dem Inverkehrbringen, einschließlich der EU MDR für die Überwachung nach dem Inverkehrbringen und der Bearbeitung von Beschwerden über Medizinprodukte FDA .
Post-Market Surveillance Dienstleistungen
Produkte Reklamationsmanagement
End-to-end von der Entgegennahme über die Meldung bis zum Abschluss, das eine effiziente, effektive und zeitnahe Bearbeitung von Beschwerden als Teil robuster PMS-Prozesse für Medizinprodukte gewährleistet.Rückruf- und Retourenmanagement für Geräte
Unser Expertenteam unterstützt Sie bei der Einhaltung komplexer Vorschriften im Zusammenhang mit dem Rückruf von Medizinprodukten und Sicherheitsmaßnahmen im Feld und sorgt für Konformität, Effizienz und minimale Unterbrechungen.Berichtigungen und Umzüge
Unser Team unterstützt Sie bei der Risikobewertung, der Kommunikation mit Regulierungsbehörden und Kunden und sorgt für eine konforme Dokumentation.PMSP, PMSR, PMCF, PSUR, Jährliche Wartung
Umfassende Unterstützung bei der Erstellung, Aktualisierung und Pflege der PMS-Dokumentation, einschließlich PMS-Pläne, PMS-Berichte, PMCF-Dienste, PSURs und jährliche regulatorische Aktualisierungen durch Experten für die Überwachung nach der Markteinführung von Medizinprodukten.Mehrkanalige und mehrsprachige Unterstützung durch das Contact Center
Unsere engagierten lokalen Niederlassungen in mehreren Ländern auf der ganzen Welt ermöglichen einen kosteneffizienten und zeitnahen Support, der den Kundenservice verbessert.Medizinische Anfrage und Antwort
Als Schnittstelle zwischen dem Zulassungsinhaber und dem Patienten oder Verbraucher sorgt unser Team für eine konsistente und kontrollierte Beantwortung der Anfragen, die ein wesentlicher Bestandteil der Überwachung nach dem Inverkehrbringen ist.Bewertung der Gesundheitsgefährdung
Wir führen wissenschaftliche, evidenzbasierte Bewertungen durch, um den Schweregrad und die Wahrscheinlichkeit von Schäden zu beurteilen, die sich aus Produktproblemen ergeben, und bilden so die Grundlage für die Kommunikation mit den Behörden und die Entscheidungsfindung in Bezug auf Rückrufe oder FSCA.Übersetzungsdienst für medizinische Geräte
Präzise, vorschriftenkonforme Übersetzung aller PMS-bezogenen Dokumente, einschließlich Beschwerden, Kundenkommunikation, FSNs, Patienteninformationen, IFUs, Etiketten und regulatorischer Berichte durch Muttersprachler mit Fachwissen.
FreyrPost-Market Surveillance Services
Erfolgreiche Kunden feiern
Warum eine Partnerschaft mit Freyr?













