Compliance-, Audit- und Validierungsdienste - Überblick
Sind Sie compliant? Diese Frage ist für jedes Unternehmen aus den Bereichen Pharmazie, Biotechnologie, Genomik, Chemie, Medizinprodukte und Lieferkettenmanagement eine Herausforderung. Diese Unternehmen müssen in allen Ländern, in denen ihre Produkte vertrieben werden, strenge Qualitäts-, Sicherheits- und Compliance-Anforderungen erfüllen. Der aktuelle Trend beim Management der Einhaltung gesetzlicher Vorschriften geht in Richtung einer globalen Harmonisierung von Qualität und Sicherheit. Unabhängig davon, ob Sie ein Hersteller oder ein Lieferant sind, hängen Ihre Marktexpansion, Ihre kontinuierliche Verbesserung und die Zufriedenheit Ihrer Kunden in erster Linie von den Qualitätsstandards Ihres Unternehmens ab. Das Center of ExcellenceCoE) für Regulatory Compliance, Audit und Validierung von Freyrkann Ihnen dabei helfen, indem es Sie mit professionell unterstützten Compliance-, Audit- und Validierungsdienstleistungen für die Pharma-, Medizinprodukte-, Konsumgüter- und Gesundheitsindustrie wie cGMP (Current Good Manufacturing Practices), GCP (Good Clinical Practice), GDP (Good Distribution Practice), Good Laboratory PracticeGLP), GPVP (Good Pharmacovigilance Practice) und GxP Computer System Validation (CSV) unterstützt.
Freyr bietet Dienstleistungen in den Bereichen Einhaltung von Vorschriften, Audits und Validierung an, die eine Bewertung Ihrer Anforderungen und Vorschläge für Geschäftsprozesse beinhalten, um die Kundenzufriedenheit zu gewährleisten. Mit unseren Strategien zur Erstellung von Compliance-Audit-Berichten und -Vorbereitungen stellen wir Compliance- und Audit-Berichte (Lückenanalysen) zur Verfügung, einschließlich Vorschlägen für Korrektur- und Vorbeugungsmaßnahmen (CAPA), um potenzielle 483er und Compliance-Audit-Feststellungen von Aufsichtsbehörden zu vermeiden.
Wir bieten Dienstleistungen zur Einhaltung von Vorschriften und zur Validierung an, um sicherzustellen, dass alle Ihre Prozesse und Produkte mit den geltenden Anforderungen an Qualität, Informationssicherheit und die Einhaltung von Vorschriften übereinstimmen, z. B. (aber nicht nur) mit den folgenden:
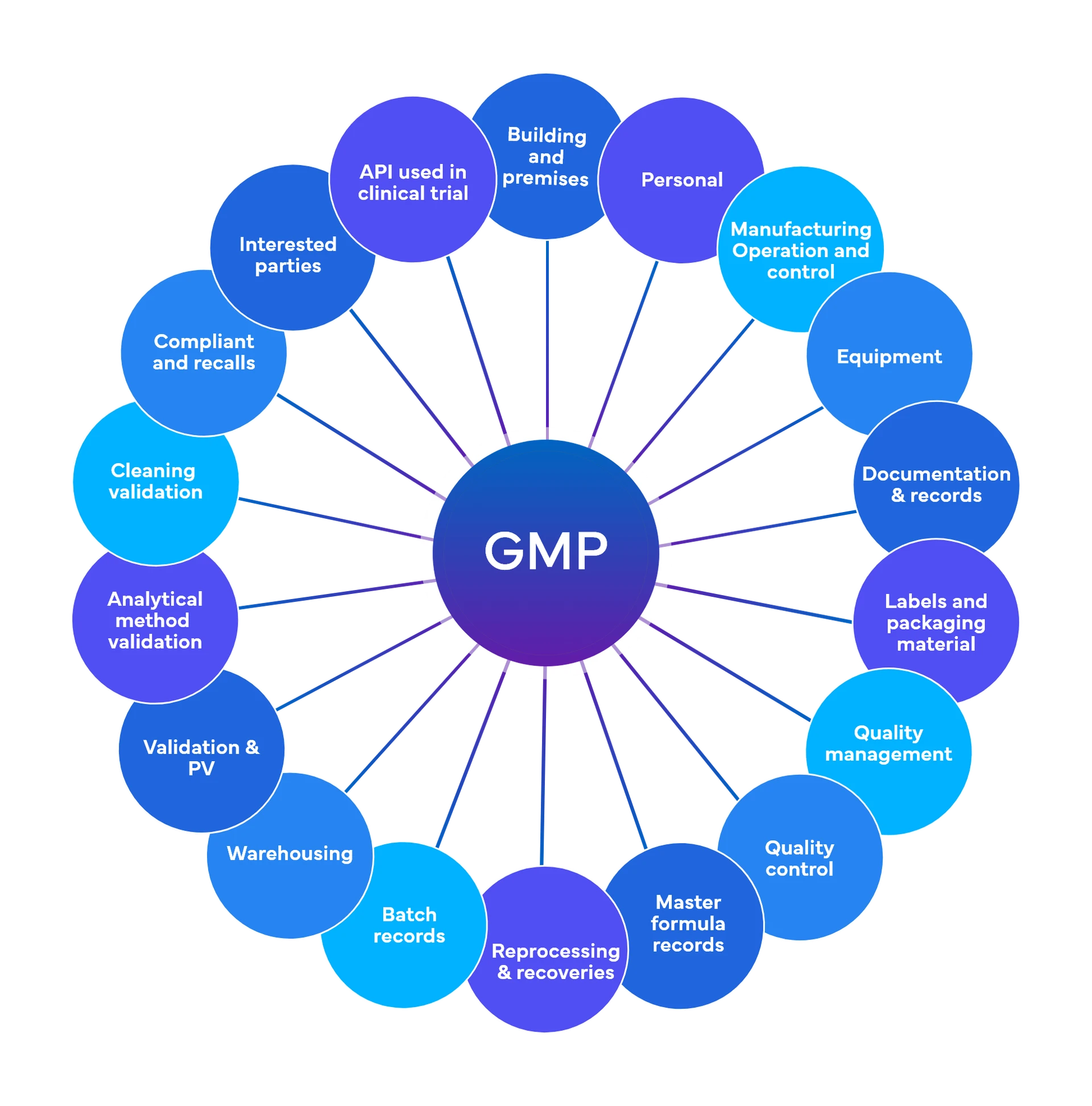
Freyr führt rund 700 Kontrollen auf vorläufiger Ebene in 18-19 GMP-Funktionsbereichen durch
FreyrEinhaltung, Prüfung und Validierung
Compliance-, Audit- und Validierungsdienste
Qualität und Einhaltung gesetzlicher Vorschriften - Aktuelle Gute Herstellungspraxis (cGMP)
- ISO / IEC 17025: 2017 - Allgemeine Anforderungen an die Kompetenz von Prüf- und Kalibrierlaboratorien
- OECD (Organisation für wirtschaftliche Co und Entwicklung) - Leitlinien der Guten Laborpraxis
- EURACHEM / CITAC-Leitfaden: Guide to Quality in Analytical Chemistry - An Aid to Accreditation, 3rd Edition (2016), sollte bei analytischen Verfahren befolgt werden
- 21 CFR 58: Gute Laborpraxis für nicht-klinische Laborstudien
- Guide to UK GLP Regulations, Feb 2000 (von GLPMA)
- WHO zur Guten LaborpraxisGLP): Qualitätspraktiken für regulierte nichtklinische Forschung und Entwicklung
- Health Canada: Abgeschlossenes Leitliniendokument - Nichtklinische Labordaten zur Unterstützung von Arzneimittelanträgen und -einreichungen: Einhaltung der Guten Laborpraxis
- OSHA (Occupational Safety and Health Administration) Normen
- Anwendbare ICH
Gute Laborpraxis
- ISO / IEC 17025: 2017 - Allgemeine Anforderungen an die Kompetenz von Prüf- und Kalibrierlaboratorien
- OECD (Organisation für wirtschaftliche Co und Entwicklung) - Leitlinien der Guten Laborpraxis
- EURACHEM / CITAC-Leitfaden: Guide to Quality in Analytical Chemistry - An Aid to Accreditation, 3rd Edition (2016), sollte bei analytischen Verfahren befolgt werden
- 21 CFR 58: Gute Laborpraxis für nicht-klinische Laborstudien
- Guide to UK GLP Regulations, Feb 2000 (von GLPMA)
- WHO zur Guten LaborpraxisGLP): Qualitätspraktiken für regulierte nichtklinische Forschung und Entwicklung
- Health Canada: Abgeschlossenes Leitliniendokument - Nichtklinische Labordaten zur Unterstützung von Arzneimittelanträgen und -einreichungen: Einhaltung der Guten Laborpraxis
- OSHA-Normen (Occupational Safety and Health Administration)
- Anwendbare ICH
Gute klinische Praxis (GCP) und gute Pharmakovigilanzpraxis (GVP)
- ICH Harmonisierte dreiteilige Leitlinie: Leitlinie für die gute klinische Praxis - E6
- E2B(R3) Individual Case Safety Report (ICSR) Spezifikation und zugehörige Dateien
- E2C(R2) Regelmäßiger Bericht zur Nutzen-Risiko-Bewertung (PBRER)
- Andere geltende ICH
- Leitlinien für eine gute Pharmakovigilanz-Praxis (GVP) Module
- FDA für INDs und BA/BE
- Sicherheitsberichte nach dem Inverkehrbringen von Humanarzneimitteln und biologischen Produkten einschließlich Impfstoffen
- Regionale Implementierungsspezifikationen der FDA für die Meldung von ICH E2B(R3) an das FDA Adverse Event Reporting System (FAERS)
- Einreichung von Unterlagen in elektronischem Format - Technische Fragen und Antworten zu den nicht überarbeiteten ICSRs nach der Markteinführung
- E2E Pharmakovigilanz-Planung
Informationssicherheit, Datenschutz und Validierung von Computersystemen (CSV)
- ISO 27001: 2013 Informationstechnik - Sicherheitstechniken - Informationssicherheitsmanagementsystem - Anforderungen
- ISO 27002: 2013 Informationstechnologie - Sicherheitstechniken - Verfahrenskodex für das Informationssicherheitsmanagement
- USFDA 21 CFR Part 11: Elektronische Aufzeichnungen; Elektronische Signaturen - Geltungsbereich und Anwendung
- EU-GMP-Leitfaden Anhang 11
- Japanische ERES-Richtlinie Notifikation Nr. 0401022
- GAMP 5: Ein risikobasierter Ansatz für GxP-konforme computergestützte Systeme
- USFDA - Richtlinien zur Software-Validierung
- Anwendbare ICH QSEM-Leitlinien
- Planung und Erstellung von SOPs und Kontrolle der Produktionsanlagen
- Integriertes Prozessmodell
- Pflege des Markenimages
- Dienstleistungen zur Risikobewertung
- Gesamtkosteneinsparungen
- Implementierung effektiver und gesetzeskonformer Geschäftsprozesse
- Erarbeitung von Validierungs- und Qualifizierungsstrategien
- Fachwissen über die Einhaltung von Vorschriften und Audits
- Fachkundige Compliance-Prüfer


 Compliance und Audit-Dienstleistungen
Compliance und Audit-Dienstleistungen







