Literaturrechercheprotokoll und Überprüfung von Medizinprodukten - Überblick
Im komplexen Bereich der Medizinprodukte und der In-vitro-Diagnostik (IVD) geht die Bedeutung eines gut strukturierten Protokolls für die Literaturrecherche und -bewertung von Medizinprodukten über die reine Forschungsarbeit hinaus. Es erweist sich als Eckpfeiler für die Einhaltung strenger Sicherheits- und Leistungsanforderungen, die in Verordnungen wie der Medizinprodukteverordnung der Europäischen UnionEU MDR) 2017/745 und der In-vitro-Diagnostik-Verordnung der Europäischen Union (EU IVDR) 2017/746 festgelegt sind.
EU MDR Literaturübersicht
Die Literaturrecherche spielt eine entscheidende Rolle im Lebenszyklusmanagement eines Medizinprodukts. Eine systematische EU MDR ist das Rückgrat für den Erfolg der klinischen Bewertung, der Leistungsbewertung und sogar der Überwachung nach dem Inverkehrbringen und der klinischen/leistungsbezogenen Folgeberichte nach dem Inverkehrbringen. Auf der Grundlage einer systematischen Literaturrecherche ist diese Übersicht nicht nur eine Phase, sondern auch ein Wegweiser für eine fundierte Entscheidungsfindung.
Die Macht eines robusten Teams für die Synthese wissenschaftlicher Literatur
Hersteller, die sich im komplizierten Bereich der Medizinprodukte und IVDs bewegen, benötigen mehr als eine routinemäßige Literaturübersicht. Ein solides Team für die wissenschaftliche Literatursynthese, das über fundiertes Fachwissen in den therapeutischen Bereichen verfügt, ist der Kompass, der sie durch das Labyrinth der regulatorischen Anforderungen führt und sicherstellt, dass die Vorschriften nicht nur eingehalten, sondern sogar übertroffen werden.
EU MDR
Die folgenden Phasen bilden den Prozess des EU MDR :
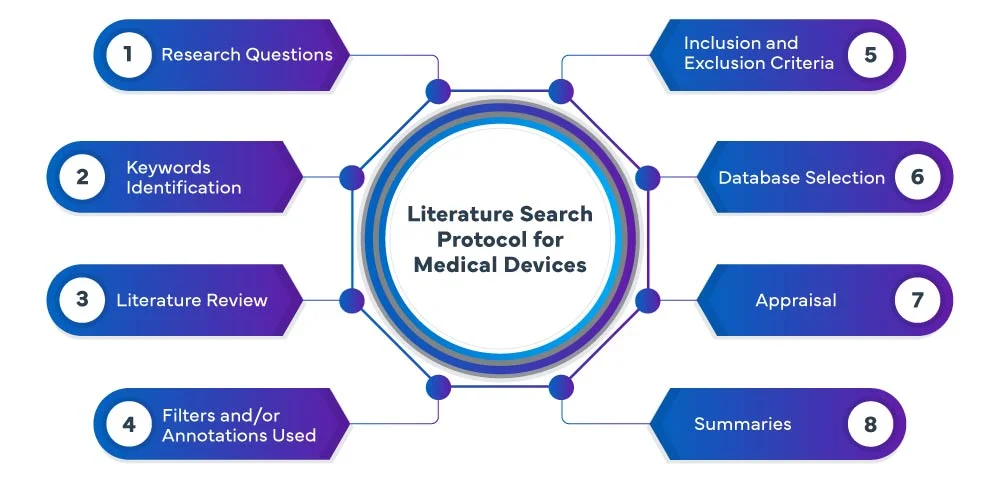
Bei Freyr führen wir eine systematische und umfassende Literaturrecherche für Medizinprodukte in verschiedenen Datenbanken wie PubMed, Embase und Cochrane durch, um relevante Studien und Veröffentlichungen zu Ihrem Medizinprodukt zu identifizieren. Unser Team setzt fortschrittliche Suchstrategien ein, um sicherzustellen, dass wir alle relevanten Nachweise erfassen. Wir analysieren die Ergebnisse sorgfältig und fassen sie zusammen, so dass Sie eine umfassende Übersicht erhalten, die als Grundlage für die Entwicklung oder den Bewertungsprozess Ihres Geräts dient.
Wir wissen, dass jedes Medizinprodukt einzigartig ist und jede Produktkategorie maßgeschneiderte Lösungen erfordert. Wir arbeiten eng mit Ihnen zusammen, um Ihre Anforderungen zu verstehen und Ihnen maßgeschneiderte Dienstleistungen anzubieten, die Ihre Ziele effektiv erfüllen.
Protokoll und Überprüfung der Literaturrecherche für Medizinprodukte
- Identifizieren, Suchen, Analysieren und Zusammenstellen der entsprechenden wissenschaftlichen Literatur.
- Strategische Planung der Suchbegriffe und Einschluss/Ausschluss der Kriterien.
- Identifizierung der geeigneten Datenbank für den Literaturrecherchebericht entsprechend den Anforderungen.
- Zusammenstellung der Literaturdaten.
- Sichtung der einschlägigen Literatur.
- Integration von PMS-Daten (falls zutreffend).
- Dokumentieren und Berichten.
- Erstellung des Clinical Evaluation Report (CER) gemäß der EU MDR 2017/745.
- Erstellung eines Clinical Evaluation Plan (CEP) ) für Ihre Organisation.
- Durchführung einer Lückenbewertung der bestehenden CEP.

- Sicherstellung der Einhaltung der jüngsten geltenden Vorschriften.
- Ein Team von qualifizierten klinischen Experten.
- Skalierbarkeit des Teams.
- Maßgeschneiderte Lösungen für Ihre Anforderungen.
- Funktionsübergreifende Beiträge von Experten für Medizinprodukte zur Erfüllung der Anforderungen.
- Umfassende Dienstleistungen in den Bereichen Einhaltung der Vorschriften, Überprüfung und Planung.





