Überblick über die USFDA von Medizinprodukten vor der Markteinführung
Das USFDA Approval (PMA)-Verfahren US FDA ist eines der von derFDA angebotenen Verfahren zur Registrierung von Medizinprodukten und in erster Linie für Medizinprodukte FDA III vorgesehen. Das FDA für Produkte der Klasse III umfasst sorgfältige wissenschaftliche und behördliche Bewertungen zur Beurteilung der Sicherheit und Wirksamkeit des Medizinprodukts, um sicherzustellen, dass vor der Marktzulassung die höchsten Standards erfüllt sind.
Buchen Sie einen Termin mit unseren Experten für die Marktzulassung
Who sollte einen PMA-Antrag (Premarket Approval) USFDA für ein Medizinprodukt einreichen?
Gerätehersteller müssen einen PMA-Antrag stellen, wenn das Gerät:
- Ist neu.
- Gehört zu einer Hochrisikogruppe.
- Kann nicht in der Produktklassifizierungsdatenbank gefunden werden.
- nicht im Wesentlichen gleichwertig (NSE) mit Produkten der Klasse I, II oder III ist.
Holen Sie sich fachkundigen Rat für Ihren Antrag auf Zulassung vor dem Inverkehrbringen
Was ist der Unterschied zwischen 510(k)-, PMA- und De-Novo-Anträgen?
Zulassung vor dem Inverkehrbringen
- Produkt der Klasse III, das menschliches Leben unterstützt oder ein potenzielles, unangemessenes Krankheits- oder Verletzungsrisiko darstellt.
- Das PMA-Zulassungsverfahren FDA erfordert klinische Studien.
- Vor der Erteilung der PMA-Genehmigung ist eine Inspektion vor Ort erforderlich.
- 180 Kalendertage
De-Novo-Klassifizierung
- Neuartige Produkte der Klassen I und II, für die es kein gültiges Prädikatsprodukt gibt.
- Erfordert Daten aus klinischen Studien.
- Keine Vor-Ort-Prüfung vor der De-Novo-Genehmigung.
- 150 Kalendertage.
510(k)-Registrierung
- FDA der Klasse III, die im Wesentlichen gleichwertig mit dem Prädikatsprodukt sind.
- Es sind keine Versuche am Menschen erforderlich.
- Keine Vor-Ort-Prüfung vor der 510(k)-Zulassung.
- 90 Kalendertage.
Was sind die verschiedenen FDA für die Zulassung vor dem Inverkehrbringen?
Die Hersteller können sich für eine der folgenden vier (04) PMA-Antragsmethoden entscheiden, die für ihr Gerät am besten geeignet sind:
- Traditionelle PMA
- Modularer PMA
- Protokoll zur Produktentwicklung
- Befreiung für humanitäre Einrichtungen
Was sind die Datenanforderungen für die Zulassung von Medizinprodukten vor der Markteinführung?
Gemäß 21 CFR Teil 814 müssen Antragsteller ein ordnungsgemäß ausgefülltes CDRH-Antragsformular, die erforderlichen Verpflichtungserklärungen und eine gut ausgearbeitete PMA-Technikdatei bei der US FDA einreichen. Die Technikdatei muss die nichtklinischen und klinischen Daten enthalten.
Nicht-klinische Daten - Sie umfassen Daten zu Mikrobiologie, Toxikologie, Immunologie, Biokompatibilität, Stress, Verschleiß, Haltbarkeit und anderen Labor- oder Tierversuchen.
Klinische Daten - Dazu gehören Daten zu Studienprotokollen, Daten zur Sicherheit und Wirksamkeit, unerwünschte Reaktionen und Komplikationen, Geräteausfälle und -ersatz, Patienteninformationen, Patientenbeschwerden, Tabellierungen der Daten aller einzelnen Probanden, Ergebnisse statistischer Analysen und alle anderen Informationen aus den klinischen Prüfungen.
Wie sieht das PMA-Antragsverfahren aus?
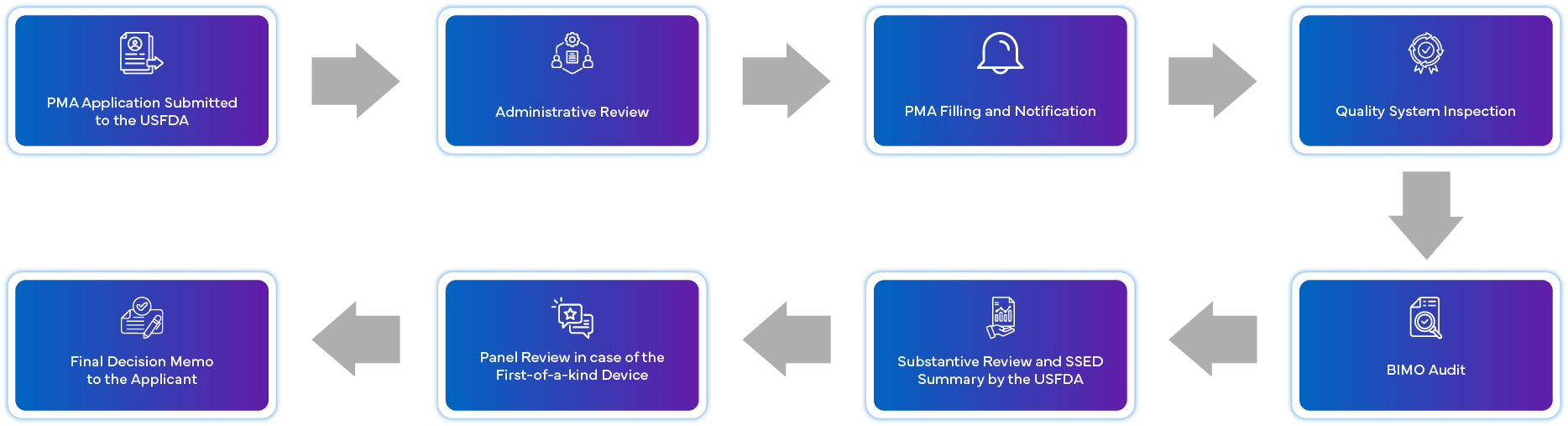
Was sind die Anforderungen an die Einhaltung der PMA nach der Zulassung?
Die im Rahmen des PMA-Pfads zugelassenen Produkte müssen die von der USFDA festgelegten Anforderungen für die Zeit nach der Markteinführung erfüllen. Das Produkt muss die folgenden Anforderungen erfüllen:
- Die in der PMA-Zulassungsanordnung FDA auferlegten Anforderungen nach der Zulassung.
- Änderungsmanagement nach der Zulassungdurch rechtzeitige Einreichung der relevanten PMA-Ergänzungen
- Einreichung von Berichten nach der Zulassung (Jahresberichte)
- 21 CFR 803 Vorschriften für die Berichterstattung über Medizinprodukte (MDR)
- Studien zur Überwachung nach dem Inverkehrbringen, wievon der USFDA in den PMA-Zulassungsbescheiden gefordert.
Wie hoch sind die USFDA für die Prüfung des PMA-Antrags?
Die MDUFA-Gebühren für Original-PMA und Ergänzungen sind wie folgt
| Art der Anwendung | Gebühren für das Steuerjahr 2023 (sup . Oktober 2022 bis sup . September sup) | |
|---|---|---|
| Standardgebühr | Gebühr für Kleinunternehmen | |
| PMA, PDP, PMR, BLA | $441,547 |
|
| Panel-Track Ergänzung | $353,238 | $88,309 |
| 180-Tage-Beilage | $66,232 | $16,558 |
| Jahresgebühr für die regelmäßige Berichterstattung über ein Produkt der Klasse III (PMAs, PDPs und PMRs) | $15,454 | $3,864 |
| 30-Tage-Kündigung | $7,065 | $3,532 |
| Real-Time Ergänzung | $30,908 | $7,727 |
Mit seiner Erfahrung im Umgang mit PMA-Anträgen kann Freyr bei der Identifizierung und Zusammenstellung der Informationen sowie bei der Vorbereitung und Prüfung des Antrags behilflich sein.
Kompetenz und Vorteile USFDA für die Zulassung von Medizinprodukten vor der Markteinführung
- Regulatorische Due Diligence
- Einhaltung des Qualitätssicherungssystems bei Inspektionen
- BIMO Audit Compliance
- Zusammenstellung der technischen PMA-Dateien
- Veröffentlichung und Erstellung von eCopy
- Validierung und Einreichung von eCopy
- Beantwortet die RTA-Antwort und die Unzulänglichkeiten
- Liaising Services bis zur FDA
- Konsultation bei Mängeln
- Geräteauflistung und Betriebsregistrierung
- Verwaltung von PMA-Ergänzungen und 30-Tage-Benachrichtigungen
- Jährliche periodische Berichterstattung
- Mock Audits und 21 CFR 820 Ausbildung

- Erfahrung in der Bearbeitung zahlreicher FDA für verschiedene Gerätekategorien.
- Expertenteam für die Beantragung der FDA vor dem Inverkehrbringen gemäß den gesetzlichen Anforderungen
- Zusätzliche Unterstützung bei der Bearbeitung von Fragen im Zusammenhang mit der PMA.
- Pünktliche Einreichung der Arbeitsergebnisse
- Auf dem neuesten Stand derFDA Änderungen der US FDA
