Überblick über die Registrierung von Medizinprodukten Health Canada
Kanada verfügt mit einigen der strengsten Richtlinien über eines der besten Regulierungssysteme der Welt für Medizinprodukte. In Kanada werden alle Medizinprodukte von Health Canada, Health Products and Food Branch, Therapeutic Products Directorate, Medical Devices Bureau, reguliert. Health Canada prüft Medizinprodukte auf ihre Sicherheit, Wirksamkeit und Qualität, bevor sie gemäß der 1998 eingeführten kanadischen Medizinprodukteverordnung SOR/98-282 für den Verkauf in Kanada zugelassen werden. Freyr ist ein aktiver Partner von Medizintechnikunternehmen, um sie bei der Einhaltung der Richtlinien für die Registrierung von Medizinprodukten Health Canada zu unterstützen.
Regulierungsbehörde: Health Canada
Verordnung: Verordnung über Medizinprodukte (SOR/98-282)
Bevollmächtigter Vertreter: Nicht erforderlich
QMS-Anforderung: Einhaltung der ISO 13485:2016 als Medical Device Single Audit Program MDSAP)
Bewertung der technischen Daten: Health Canada
Gültigkeit der Lizenz: Unbegrenzt
Kennzeichnungsvorschriften: Teil 21 der MDR (SOR/98-282)
Format der Einreichung: Papier
Sprache: Englisch und Französisch
Health Canada Klassifizierung von Medizinprodukten
Das Klassifizierungssystem für Medizinprodukte Health Canada lehnt sich stark an die Richtlinie 93/42/EWG des Rates der Europäischen Union an. Viele der Regeln und Auslegungen von Begriffen entsprechen den von der Europäischen Union vorgeschlagenen. Es trifft jedoch nicht unbedingt zu, dass ein Medizinprodukt, das nach dem Klassifizierungssystem der Europäischen Union in eine Klasse eingestuft wurde, auch nach dem kanadischen Klassifizierungssystem für Medizinprodukte in dieselbe Klasse eingestuft wird. Der Antragsteller muss die in den Verordnungen dargelegten Regeln befolgen, um die geeignete Klassifizierung für sein Produkt in Kanada zu bestimmen.
Zur Erstellung der kanadischen Klassifizierungsregeln wurden die folgenden Indikatoren für das von einem bestimmten Produkt ausgehende Risiko verwendet: Grad der Invasivität, Dauer des Kontakts, betroffenes Körpersystem und lokale bzw. systemische Auswirkungen.
| Geräteklasse | Risiko |
|---|---|
| I | Niedrig |
| II | Gering-Mäßig |
| III | Hoch-Mäßig |
| IV | Hoch |
Kanada Bevollmächtigter Vertreter
Es ist nicht erforderlich, dass der Hersteller einen Bevollmächtigten in Kanada benennt. Der Händler muss jedoch die Anforderungen von Health Canada an die gute VertriebspraxisGDP) erfüllen.
Registrierung von Medizinprodukten-Kanada
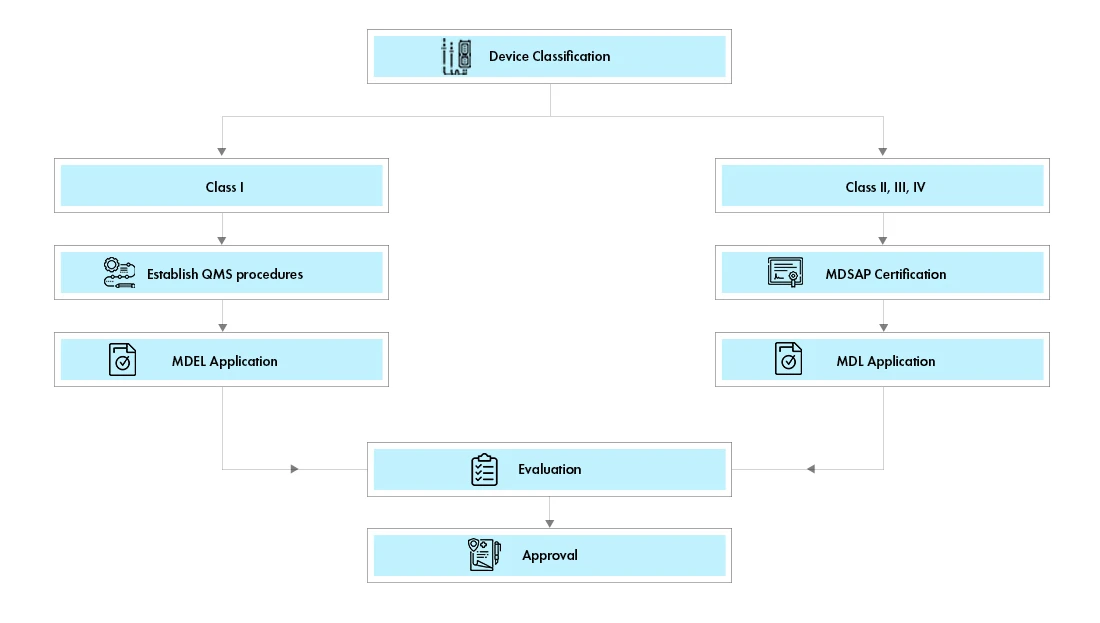
Für die Registrierung von Medizinprodukten in Kanada gibt es zwei Wege:
Lizenz zur Herstellung von Medizinprodukten (MDEL): Geräte der Klasse I können eine Medical Device Establishment License Canada (MDEL) beantragen, indem sie die vorgeschriebenen Verfahren vorbereiten und die Gebühren Health Canada entrichten.
Lizenz für Medizinprodukte (MDL): Für Produkte der Klassen II, III und IV ist ein Antrag auf eine kanadische Lizenz für Medizinprodukte (MDL) zu stellen. Die Anforderungen an die Dokumente für die einzelnen Geräteklassen sind unterschiedlich.
Prozessablauf
Management des Lebenszyklus von Geräten nach der Zulassung
Freyr ausländische Hersteller beim end-to-end , einschließlich Aktivitäten nach der Zulassung, wie zum Beispiel:
- Änderungsmanagement nach der Zulassung - Änderungen bestehender Zulassungen für Medizinprodukte, z. B. Hinzufügung neuer Varianten und Zubehörteile, Hinzufügung neuer Anwendungsgebiete usw.
- Aufrechterhaltung von Zulassungen und Registrierung durch rechtzeitige Zahlung von Verwaltungs- und Registrierungsgebühren
- Erneuerung von Lizenzen
- Kontaktaufnahme zwischen Health Canada und dem Hersteller
Zusammenfassung
| Risiko | Geräteklasse | QMS-Audit | Regulierungspfad | Anforderungen an das Dokument | Zeitpläne von Health Canada |
|---|---|---|---|---|---|
| Niedrig | I | NA | MDEL |
| NA |
| Gering-Mäßig | II | MDSAP | MDL |
| 15 Tage |
| Hoch-Mäßig | III | MDSAP | MDL |
| 60 Tage |
| Hoch | IV | MDSAP | MDL |
| 75 Tage |
FreyrDienstleistungen für die Registrierung von Medizinprodukten
Freyr-Podcasts
- Health Canada Klassifizierungs- und Gruppierungsdienste für Medizinprodukte
- Registrierung von Medizinprodukten, Kanada
- Treffen mit Health Canada vor der Einreichung
- MDSAP, Kanada
- Vertriebspartner Identifizierung/Qualifizierung des Vertriebspartners zur Einhaltung der Health Canada
- Medizinprodukte-Einrichtungslizenz Kanada (MDEL)
- Lizenzierung von Medizinprodukten in Kanada (MDL)
- Änderungsmanagement nach der Genehmigung
- Kennzeichnungsdienstleistungen gemäß den Health Canada Kennzeichnungsanforderungen für Medizinprodukte