
Überblick über die Registrierung von Medizinprodukten in Europa
Die aus 27 member states bestehende EU hat die Verordnung über Medizinprodukte (MDR) 2017/745 und die Verordnung über In-vitro-Diagnostika (IVDR) 2017/746 entwickelt, die kürzlich vollständig umgesetzt wurden. Diese Verordnungen sind ein integraler Bestandteil des europäischen Registrierungsverfahrens für Medizinprodukte und haben nun die Richtlinien ersetzt. Beide Verordnungen enthalten neue, zusätzliche Anforderungen, und diese werden die zentralen Regulierungsverfahren sein, die beim Inverkehrbringen von Medizinprodukten in einem der 27 Länder zu befolgen sind. Ausländische Hersteller von Medizinprodukten who keinen physischen Standort in Europa haben, müssen einen Europäischen Bevollmächtigten (EAR) benennen, der sie bei der Einhaltung dieser Vorschriften unterstützt.
Regulierungsbehörde: Zuständige nationale Behörde
Verordnung: Medizinprodukteverordnung (MDR) 2017/745, In-vitro-Diagnostika-Verordnung 2017/746
Regulierungspfad: CE-Kennzeichnung gefolgt von Registrierung/Notifizierung
Bevollmächtigter Vertreter: Europäischer Bevollmächtigter (EAR) für Nicht-EU-Hersteller
QMS-Anforderung: ISO 13485:2016
Bewertung der technischen Daten: Benannte Stelle für die CE-Kennzeichnung
Klassifizierung der Geräte
Die Klassifizierung des Produkts ist der erste Schritt bei der Festlegung des Regulierungsweges für das jeweilige Produkt. Es gibt etwa 22 Durchführungsbestimmungen für Medizinprodukte, die wie folgt klassifiziert werden
| Klasse | Risiko |
|---|---|
| Klasse I | Niedrig |
| Klasse IIa | Mäßig |
| Klasse IIb | Mäßig bis hoch |
| Klasse III | Hoch |
In ähnlicher Weise werden für IVD etwa 7 Regeln implementiert, die in die folgenden vier Kategorien eingeteilt werden
| Klasse | Risiko |
|---|---|
| Klasse A | Niedrig |
| Klasse B | Mäßig |
| Klasse C | Mäßig bis hoch |
| Klasse D | Hoch |
In Anbetracht der speziellen Anweisungen für die verschiedenen Klassen ist die Bestimmung der richtigen Geräteklasse von entscheidender Bedeutung für die Festlegung des Regulierungsweges.
Europäischer Bevollmächtigter (EAR)
Jeder ausländische Hersteller, der seine Produkte im EU-Raum auf den Markt bringen will, ist verpflichtet, einen Europäischen Bevollmächtigten (EAR ) gemäß Artikel 11 der EU MDR und IVDR zu benennen.
Registrierung von Medizinprodukten
Um Medizinprodukte in der EU vermarkten zu können, ist die CE-Kennzeichnung obligatorisch. Die Hersteller müssen die benannten Stellen ermitteln und benennen, sich der Konformitätsbewertung unterziehen und eine CE-Zertifizierung ausstellen.
Die Dekodierung von Rechtsvorschriften für die Registrierung von Geräten oder die Meldung über ein Online-Registrierungssystem kann sich ohne die Hilfe eines Experten als schwierig erweisen.
Prozessablauf
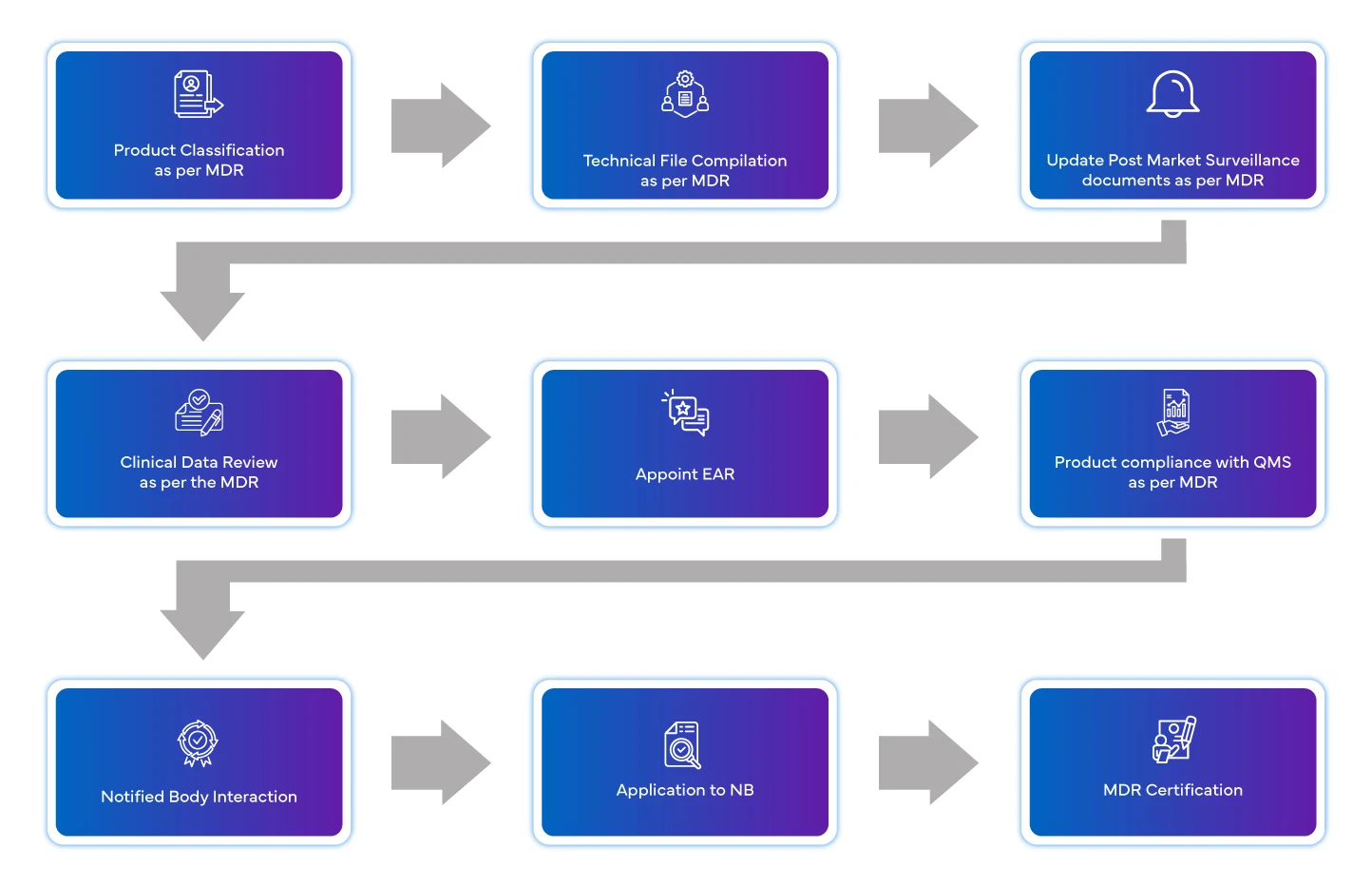
Management des Lebenszyklus von Geräten nach der Zulassung
Die europäischen Vorschriften für Medizinprodukte betonen nun die Bedeutung der Anforderungen nach dem Inverkehrbringen. Der Hersteller ist verpflichtet, ein Überwachungsmanagementsystem einzurichten. Für das Produkt ist eine regelmäßige Information zu erstellen.
Freyr kann Sie bei der Erstellung post-market surveillance (PMS) , des Berichts zur Überwachung nach dem Inverkehrbringen (PMSR), des regelmäßigen Sicherheitsberichts (PSUR) und der klinischen Nachbeobachtung nach dem Inverkehrbringen (PMCF)/Leistungsnachbeobachtung nach dem Inverkehrbringen (PMPF) unterstützen.
Die Unterstützung Freyr umfasst auch Aktivitäten wie -
- Änderungsmanagement nach der Zulassung - Änderungen bestehender Zulassungen für Medizinprodukte, z. B. Hinzufügung neuer Varianten und Zubehörteile, Hinzufügung neuer Anwendungsgebiete usw.
- Aufrechterhaltung der ISO 13485:2016- und CE-Zertifizierung
- Erneuerung von Lizenzen
- Verbindung zwischen der benannten Stelle und dem Hersteller
Europa Registrierung von Medizinprodukten
Freyr-Podcasts
- Europäische Klassifizierung von Medizinprodukten
- Unterstützung durch den Europäischen Bevollmächtigten (EAR)
- ISO 14971:2019 Beratung zum Risikomanagement
- Einhaltung der ISO 13485:2016
- Überprüfung, Zusammenstellung und Einreichung der technischen CE-Unterlagen/Geschmacksmusterdossiers
- EU MDR
- EU IVDR-Übergangsunterstützung
- Clinical Evaluation Reports (CER) für Medizinprodukte
- Leistungsbewertungsberichte (PER) für In-vitro-Diagnostika
- Notifizierung/Registrierung von Medizinprodukten über das Online-Registrierungssystem
- Strategiebericht zur Regulierung von Medizinprodukten
- Testunterstützung - Biokompatibilität, elektrische Sicherheit, Mechanik und Leistung
- Unterstützung bei der Einhaltung von Etikettierungsvorschriften
- GMP-Unterstützung
- Unterstützung der Überwachung nach der Markteinführung

