Überblick über den FDA eSTAR
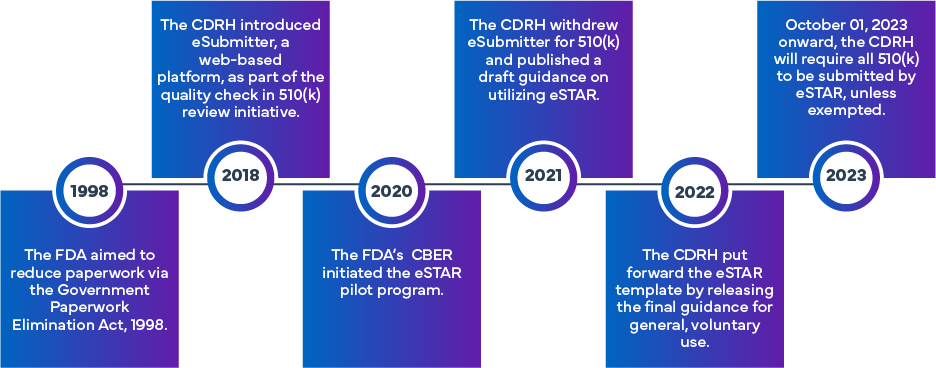
Die eSTAR-Initiative FDA wurde ins Leben gerufen, um die Effizienz und Einheitlichkeit bei der Vorbereitung und Bewertung der 510(k)- und De-Novo-Anträge FDA zu verbessern. Ausgehend von dem ursprünglichen eSubmitter-Ansatz, der die elektronische Einreichung von Medizinprodukten und IVD-Anträgen vorsah, wurde das eSTAR-Programm auf der Grundlage der bisherigen Erfahrungen der FDAins Leben gerufen. Die FDA leistete Pionierarbeit mit einem anderen Programm, dem Electronic Submission Template and Resource (eSTAR) Pilot Program. Ab dem 01. Oktober 2023 müssen 510(k)-Einreichungen (herkömmliche, abgekürzte oder spezielle 510[k]) das eSTAR-Programm verwenden. Die Vorlagen können online abgerufen werden, erfordern jedoch für den eigentlichen Einreichungsprozess die Verwendung von FDA .
Was ist der FDA eSTAR?
eSTAR ist eine interaktive PDF-Vorlage, die die Vorbereitung einer umfassenden Einreichung für Medizinprodukte vor der Markteinführung für das 510(k)-Zulassungsverfahren FDAin den US erleichtern soll. Außerdem können Antragsteller eSTAR für die Einreichung von Antworten auf Anfragen FDAnach zusätzlichen Informationen nutzen. Ziel ist es, die Qualität der Einreichungen für verschiedene Medizinprodukte zu verbessern, indem sichergestellt wird, dass die Einreicher vollständige und qualitativ hochwertige Daten für die Überprüfung FDAvor der Markteinführung bereitstellen.
Durch die Übernahme des eSTAR-Formats können die Antragsteller auf die Vollständigkeit ihrer Anträge vertrauen, was wiederum die FDA in die Lage versetzt, die Prüfungen vor dem Inverkehrbringen effizienter durchzuführen und den rechtzeitigen Zugang zu sicheren und wirksamen Medizinprodukten zu gewährleisten. Die eSTAR-Vorlage ist kostenlos erhältlich und kann von allen Einreichern von Medizinprodukten für 510(k)-, De Novo- und Q-Einreichungen bei der FDA freiwillig verwendet werden. Es gibt zwei Arten von eSTAR-Vorlagen - eine für Medizinprodukte und die andere für IVDs. Am 09. Juni 2023 hat die FDA eine Beta-Version von eSTAR (PreSTAR) für Voranmeldungen (eine Art von Q-Anmeldungen) veröffentlicht.
Merkmale und Beschränkungen von eSTAR-Einreichungen
Das eSTAR-Programm bietet ein interaktives PDF-Formular, das die Antragsteller bei der Ausarbeitung gründlicher Anträge für Medizinprodukte und IVD unterstützt. Die Antragsteller müssen diese Vorteile und Einschränkungen verstehen, damit sie fundierte Entscheidungen über die Integration von eSTAR in ihren Einreichungsprozess treffen können. In der folgenden Tabelle werden die Eigenschaften und Einschränkungen des eSTAR-Programms erläutert.

Überlegungen zur effektiven Nutzung von eSTAR
Ein vorteilhaftes Merkmal der eSTAR-Vorlage, das zur Optimierung des Einreichungsprozesses beiträgt, ist die automatische Einbindung einschlägiger Vorschriften und anerkannter Normen für Zitate. Dies beschleunigt nicht nur den Einreichungsprozess durch die Reduzierung der manuellen Dateneingabe, sondern verringert auch die Möglichkeit menschlicher Fehler, die bei der Eingabe von Vorschriften und Normen auftreten können. Durch den geführten Aufbau für jeden Einreichungsabschnitt kann die Verwendung von eSTAR im Einreichungsprozess mühelos rationalisiert werden.
- Die FDA empfiehlt Adobe Acrobat Pro oder Foxit PDF Editor für die Bearbeitung von eSTAR-Vorlagen.
- eSTAR enthält bestimmte integrierte Formulare, so dass sie nicht mehr separat ausgefüllt werden müssen. Dazu gehören das Formblatt 3514 (das Deckblatt für die Einreichung) und das Formblatt 3881 (Angaben zur Verwendung). Außerdem ist die wahrheitsgemäße und genaue Erklärung, die bisher auf dem Briefkopf eines Unternehmens erforderlich war, jetzt in eSTAR integriert.
- eSTAR unterstützt nicht nur PDFs, sondern auch andere Anhangsformate wie Excel-Tabellen und Video (mp4)-Dateien.
- Dateien in makroaktivierten und ausführbaren Formaten sind nicht zulässig.
- Die Gesamtgröße der eSTAR-PDF-Datei darf zusammen mit den Anhängen 1 GB nicht überschreiten, da Dateien mit mehr als 4 GB nicht akzeptiert werden.
- Wenn Ihre elektronischen Dateien die technischen Grenzen überschreiten, können Sie die digitale Einreichung per Post an das CDRH Document Control Center (DCC) senden.
Bewährte Praktiken für die Vorbereitung von eSTAR-Anträgen
Die Einhaltung einiger bewährter Verfahren für die Vorbereitung von eSTAR-Anträgen kann den Antragstellern helfen, den Einreichungsprozess zu straffen und ihre Chancen auf ein erfolgreiches Ergebnis zu verbessern. Hier sind einige bewährte Verfahren:
- Befolgen Sie die FDA : Die FDA bietet einen Leitfaden an, der Antragstellern hilft, die eSTAR-Vorlage erfolgreich zu nutzen. Die Befolgung dieses Leitfadens stellt sicher, dass die Anträge mit den Anforderungen und Erwartungen der FDAübereinstimmen.
- Vollständigkeit sicherstellen: Die eSTAR-Vorlage leitet die Antragsteller durch die wesentlichen Informationen, die sie einreichen müssen. Die Antragsteller müssen alle erforderlichen Angaben machen, um die Wahrscheinlichkeit von Mängeln oder zusätzlichen Informationsanforderungen zu minimieren.
- Wahrung der Konsistenz: Die eSTAR-Vorlage fördert die Einheitlichkeit des Inhalts und der Struktur von 510(k)-Anmeldungen. Ein geführter Aufbau für jeden Einreichungsabschnitt hilft, Informationen über ein Medizinprodukt zu extrahieren.
- Priorisieren Sie Klarheit: Geben Sie in den eSTAR-Anträgen klare und präzise Details an, um ein straffes Prüfverfahren zu ermöglichen. Durch eine solche Detaillierung und Präzision werden Verzögerungen und Fehler minimiert und ein rechtzeitiger Zugang zu Anträgen für Medizinprodukte vor dem Inverkehrbringen gewährleistet.
- Sichere Präzision: Die automatische Überprüfung der Informationen in den einzelnen Abschnitten der eSTAR-Anträge trägt dazu bei, Verzögerungen bei der Prüfung und mögliche Mängel zu vermeiden.
Bedeutung der Farbcodierung in der FDA eSTAR-Einreichung
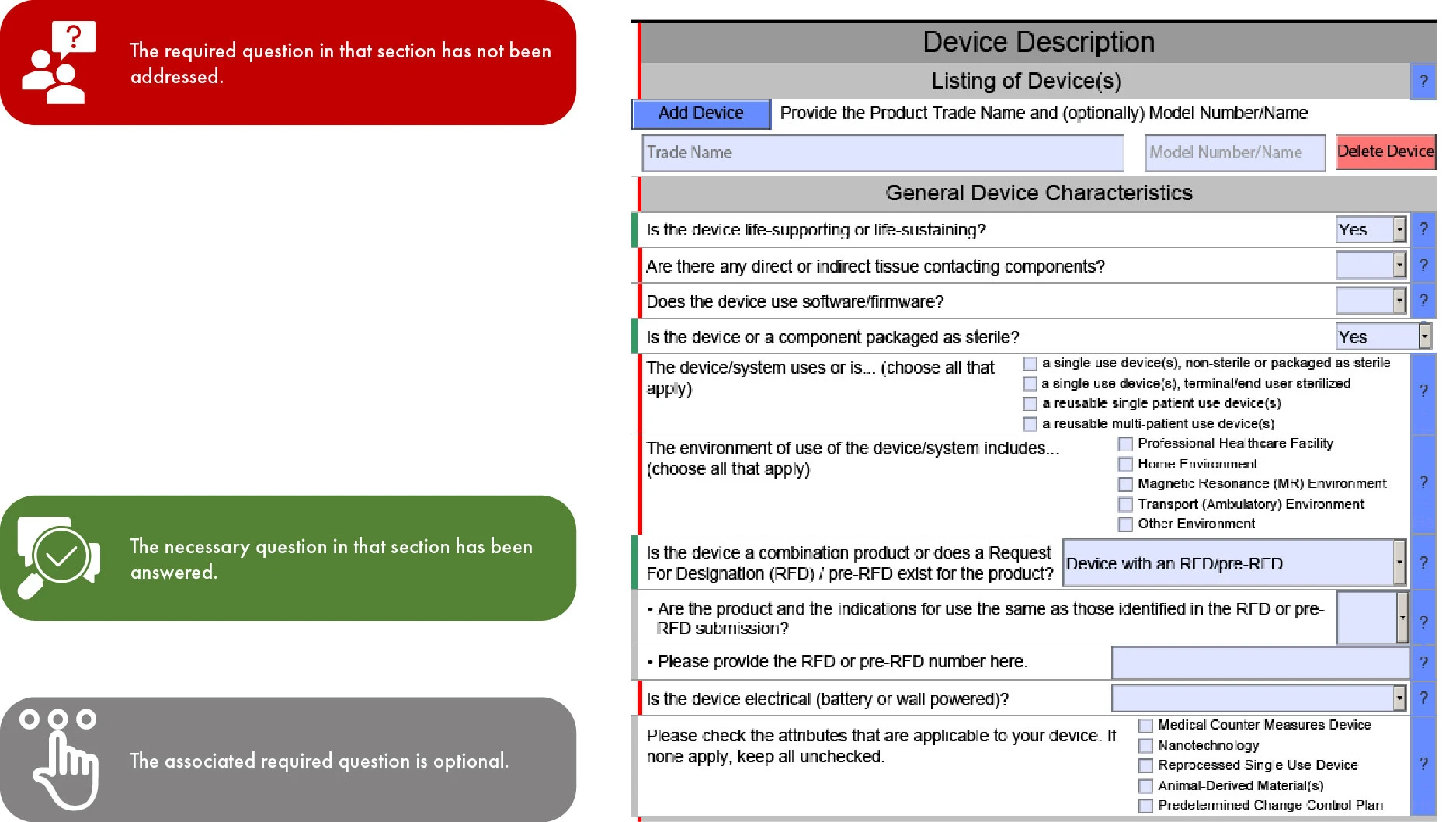
Da eSTAR ab dem 1. Oktober 2023 für 510(k)-Einreichungen obligatorisch und für De Novo freiwillig sein wird, hängt der Ablauf der Vorlage durch die einzelnen Abschnitte von der Art der Einreichung ab. Diese Art der Rationalisierung ermöglicht eine schnellere Überprüfung durch die US FDA und minimiert so Unstimmigkeiten und Auslassungen in Ihrer Einreichung. Es ist jedoch wichtig zu beachten, dass die FDA ihre Überprüfung verzögern FDA , wenn englische Übersetzungen für die bereitgestellten Unterlagen fehlen.

Ausrichten Ihrer Anhänge
Sehen Sie sich die eSTAR-Vorlage vorher an, um zu verstehen, wie die Anhänge unterteilt sind, und um sicherzustellen, dass Ihre Dokumente mit den Abschnitten für die Anhänge übereinstimmen. Dieser Schritt ist vor allem für Unternehmen mit früheren 510(k)-Einreichungen von entscheidender Bedeutung, da Ihre bisherige Vorgehensweise bei der Dokumentenorganisation möglicherweise angepasst werden muss. Dies könnte auch die Extraktion von Inhalten aus Anhängen beinhalten.
- eSTAR verlangt prägnante Anhänge, die sich von herkömmlichen Einreichungen unterscheiden.
- Erwarten Sie zahlreiche Anhänge, möglicherweise Dutzende davon.
- Anhänge ermöglichen die Aufnahme von Daten wie Excel-Tabellen, MP4-Videodateien, Word-Dokumente, JPEG-Dateien usw.
- eSTAR wünscht Seitenzahlen für Informationen im Anhang, schlägt aber nicht vor, eine Checkliste zur Annahmeverweigerung für FDA zu verwenden.
Vorlagen: Vorlagen sind unter dem angegebenen Link zugänglich: https:fda
Die Zukunft von eSTAR
Es wird davon ausgegangen, dass eSTAR nach Fertigstellung der umfassenden geltenden Leitfäden aktualisiert wird. Mit diesen Aktualisierungen kann sich der Hersteller auf die neuesten von der US FDA herausgegebenen Versionen beziehen.
Health Canada (HC) hat eine Pilotinitiative zur Einführung von eSTAR für Produkte der Klassen III und IV gestartet. Es besteht die Vermutung, dass andere Länder dem Beispiel Kanadas folgen und die Einführung von eSTAR zur Ermessenssache machen könnten, insbesondere innerhalb des IMDRF-Konsortiums. Es ist jedoch anzumerken, dass es keine ausdrücklichen Erklärungen in diesem Sinne gibt.
Warum Freyr wählen?
Freyr verfügt über eine Fülle von Fachkenntnissen, die aus der Beteiligung an zahlreichen Projekten mit Schwerpunkt auf Einreichungen bei der FDA in der Vergangenheit gewonnen wurden. Freyr unterstützt die Industrie proaktiv bei der Beschleunigung von 510(k)- und De Novo-Einreichungen und bietet eine Reihe von Kundendiensten an, die eine umfassende Liste wesentlicher Einreichungsdokumente und erforderlicher Informationen, die Durchführung akribischer Lückenanalysen der Dokumentation, die Zusammenstellung der Einreichungen über eSTAR und die Fertigstellung des Einreichungspakets vor der Markteinführung bei der FDA umfassen. Darüber hinaus bietet Freyr auch Unterstützung bei Aktivitäten nach der Einreichung, wie z. B. die Bereitstellung zusätzlicher Informationen und die Überprüfung der Antworten der Industrie auf alle von der FDA angeforderten Zusatzinformationen.
Wie wird Freyr helfen?
Freyr bietet Unterstützung bei der Vorbereitung von 510(k)- und De Novo-Einreichungen. Die Dienstleistungen umfassen:
- Unterstützung beim Regulierungspfad: Dazu gehört die Ermittlung des Produktcodes, der Bezeichnung und Nummer der Verordnung, potenzieller Prädikate/Referenzgeräte, Leistungstests sowie der geltenden Normen und Leitfäden, die für das betreffende Produkt relevant sind.
- Unterstützung bei Q-Einreichungen (Voreinreichungen): Dies beinhaltet die Unterstützung bei der Klärung von Fragen im Zusammenhang mit den Voraussetzungen für eine Einreichung vor der Markteinführung, die Organisation der Einreichung, die Vorbereitung auf ein FDA , die interaktive Kommunikation mit der FDA während des Meetings und das Verfassen eines Sitzungsprotokolls.
Die Expertise des FDA eSTAR-Programms
- Umfassende Strategie zur Regulierung FDA .
- Prädikat Geräteidentifikation.
- Feststellung der wesentlichen Gleichwertigkeit mit der Prädikatsextrakte.
- Lückenanalyse für die Einhaltung der FDA .
- Zusammenstellung von einundzwanzig (21) Abschnitten der technischen 510(k)-Datei.
- Veröffentlichung und Erstellung der eCopy.
- Validierung und Einreichung der eCopy.
- Kontakt zu den Dienststellen für die Zulassung von Produkten.
- Die Behandlung von RTA-Reaktionen und Mängeln.
- Beratungsdienste zur Beseitigung von Mängeln.
- Pflege der Geräteliste und der FURLS-Datenbank.