Clinical evaluation report (CER) für Medizinprodukte Übersicht
Jedes Produkt, das in der Europäischen Union (EU) in Verkehr gebracht werden soll, muss eine CE-Kennzeichnung tragen. Gemäß der EU MDR 2017/745 variieren die Anforderungen an einen Clinical Evaluation Report (CER), einschließlich der Anforderungen an Prozesse und Daten, je nach Klasse eines Produkts und sind für die CE-Zertifizierung von Medizinprodukten erforderlich. Produkte der Klasse I mit geringem Risiko können eine CE-Selbstzertifizierung durchführen. Im Gegensatz dazu müssen andere Produktklassen (IIa, IIb, III) die CE-Zertifizierung durch eine akkreditierte benannte Stelle (NB) durchführen. Der Hersteller muss der BS die technischen CE-Unterlagen zur Bewertung und Erteilung der CE-Kennzeichnung sowie zur Ausstellung des CE-Zertifikats vorlegen. Der Clinical Evaluation Report (CER) für Medizinprodukte muss zusammen mit den technischen CE-Unterlagen eingereicht werden, um die Anforderungen für die CE-Kennzeichnung zu erfüllen.
Der Clinical Evaluation Report (CER) für Medizinprodukte ist einer der Berichte, die zusammen mit den technischen CE-Unterlagen eingereicht werden müssen, um die CER-Anforderungen zu erfüllen.
Was ist ein Clinical Evaluation Report (CER)?
Die Erstellung eines Berichts über die klinische Bewertung umfasst die Bewertung und Analyse der klinischen Daten eines Medizinprodukts, um dessen klinische Sicherheit und Leistung zu überprüfen. Die klinische Bewertung von Medizinprodukten basiert auf einer umfassenden Analyse der klinischen Daten vor und nach dem Inverkehrbringen, die für die vorgesehene Verwendung relevant sind. Der Bericht über die klinische Bewertung enthält sowohl produktspezifische Daten als auch Daten zu Produkten, die vom Hersteller als gleichwertig bezeichnet werden.
Ein Bericht über die klinische Bewertung besteht aus wissenschaftlicher Literatur und analysierten klinischen Daten, die entweder aus einer klinischen Prüfung Ihres Produkts oder aus den Ergebnissen anderer Studien über im Wesentlichen gleichwertige Produkte gewonnen wurden. Die GEB eines Medizinprodukts zeigt, dass das Produkt seine Zweckbestimmung erfüllt, ohne Anwender und Patienten einem weiteren Risiko auszusetzen.
Die EU MDR CER muss jedes Jahr aktualisiert werden. Wenn das Produkt über einen längeren Zeitraum vermarktet wird und nachweislich sicher ist und keine signifikanten Risiken birgt, kann die CER alle 2-5 Jahre aktualisiert werden. Jede Änderung der Produktauslegung und jede neue Information aus den PMS-Daten könnte eine Aktualisierung des CER-Berichts erforderlich machen.
Die klinische Bewertung von Medizinprodukten, wie sie im Clinical Evaluation Report (CER) dargelegt ist, basiert auf den unten aufgeführten Faktoren.
- Derzeit verfügbare wissenschaftliche Literatur; und/oder
- Klinische Untersuchungen durchgeführt; oder
- Ob der Nachweis der Konformität mit den grundlegenden Anforderungen auf der Grundlage klinischer Daten als nicht angemessen erachtet wird.
Phasen der Erstellung von Clinical Evaluation Report (CER)
Gemäß der neuen EU-Medizinprodukte-Verordnung (MDR) 2017/745 gibt es vier (04) verschiedene Stufen zur Durchführung einer klinischen Bewertung von Medizinprodukten, um einen umfassenden Clinical Evaluation Report (CER) erstellen.
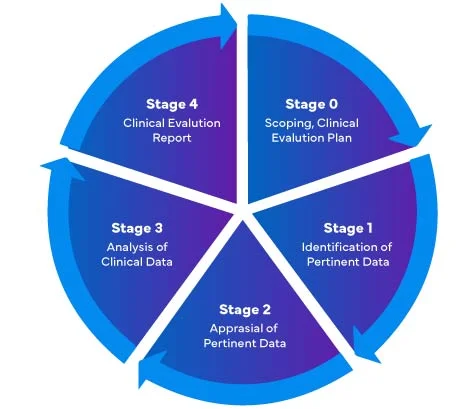
Hersteller von Medizinprodukten, die zum ersten Mal auf den EU-Markt kommen, müssen sicherstellen, dass ihr Bericht über die klinische Bewertung mit den EU MDR übereinstimmt.
Freyr Geräteherstellern end-to-end , einschließlich der Erstellung von klinischen Bewertungsberichten gemäß den neu eingeführten EU MDR . Mit seiner fundierten regionalen Expertise im Bereich Medizinprodukte in der EU Freyr die Anforderungen der Behörden und passt den klinischen Bewertungsbericht entsprechend an.
Clinical evaluation report (CER)
- End-to-end Unterstützung bei der Erstellung End-to-end Bewertungsberichte, einschließlich Literaturrecherche, gemäß MEDDEV 2.7/1 Revision 4 und den Leitlinien der EU-Medizinprodukteverordnung (MDR).
- Ausarbeitung eines Plans zur klinischen Bewertung für Ihre Organisation.
- Identifizieren, suchen, analysieren und stellen Sie die entsprechende wissenschaftliche Literatur zusammen.
- Entwickeln Sie eine Vorlage für einen klinischen Bewertungsbericht für Ihre Organisation.
- Lückenanalyse für bestehenden klinischen Bewertungsbericht.
- DMS-Tool, mit dem Ihr Team gemeinsam zur Erstellung von klinischen Bewertungsberichten beitragen kann.
- Integration von PMS-Daten.
- Entwickeln Sie eine Standardarbeitsanweisung für Ihr Team, um PMS-Daten zur Aktualisierung der klinischen Bewertungsberichte zusammenzustellen.
- Bearbeitung regelmäßiger Aktualisierungen bestehender klinischer Bewertungsberichte gemäß den MDR-Richtlinien der EU.
- PMS-Datenunterstützung für bestehende Geräte auf dem Markt.
- Einhaltung der CE-Kennzeichnung und CE-Kennzeichnungsdienste.

- Sicherstellung der Einhaltung der jüngsten geltenden Vorschriften.
- Team von qualifizierten klinischen Experten.
- Funktionsübergreifende Beiträge von Experten für Medizinprodukte zur Erfüllung der Anforderungen.
- Umfassende Dienstleistungen in den Bereichen Einhaltung der Vorschriften, Überprüfung und Planung.





