Klinische Etikettierungsdienste - Überblick
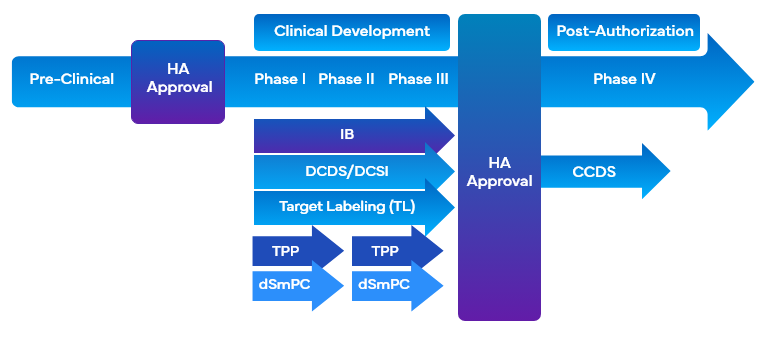
Während der Entwicklung von Arzneimitteln setzen Unternehmen eine Vielzahl von Instrumenten zur klinischen Kennzeichnung ein, die die Entwicklung von Arzneimitteln durch Target Labeling erleichtern. Mit diesen Werkzeugen werden gleichzeitig die gewünschten Ziele für die Vermarktung und die Kennzeichnung der klinischen Prüfung mit dem Design des Entwicklungsprogramms oder der Studie in Einklang gebracht und die Erstellung der klinischen ÜbersichtCO) erleichtert. Einige der Tools für die klinische Kennzeichnung, die während der Arzneimittelentwicklung das Target Labeling nutzen, sind:
- Prüfer-BroschüreIB)
- ZielmarkierungTL)/Zielprofil
- EntwicklungskerndatenblattDCDS)
- Entwicklung von KernsicherheitsinformationenDCSI)
- FDA TPP)
Für die Unternehmen ist es wichtig, einen modularen Ansatz zu verfolgen und die Informationen zur Unbedenklichkeit und Wirksamkeit über mehrere Arten von klinischen Kennzeichnungen hinweg zu sammeln, um die Anforderungen an die klinische Kennzeichnung zu ergänzen. Dies würde die Notwendigkeit erfüllen, Prüfer und Sponsoren wirksam zu unterstützen, indem ein gezielter und spezieller DCSI präsentiert und aktualisiert wird, der bequem unter verschiedenen klinischen Kategorien platziert werden kann.
Darüber hinaus wird die DCSI in die Company Core Safety InformationCCSI) aufgenommen, die die Grundlage für das erste Company Core Data SheetCCDS) bildet und für die Markteinführung des Produkts verwendet wird. Der Entwurf einer gründlich versierten CO , die den Umfang und die kritischen Punkte des klinischen Entwicklungsprogramms für das Arzneimittel umfasst, ist ebenfalls erforderlich, um die Dokumentation für die Prüfer zu unterstützen.
Freyrklinische Etikettierungsdienste
Klinische Etikettierungsdienste
- Erstellung und Überprüfung der UntersuchungsbroschüreIB)
Freyr verfügt über beträchtliche Erfahrung bei der Erstellung, dem Verfassen und der Überprüfung von Prüferinformationen für verschiedene klinische Programme unserer Kunden. IBs sind die am weitesten entwickelte Form von Etiketten, die dem Prüfarzt oder behandelnden Arzt relevante Informationen über das Medikament/die Intervention liefern sollen. Ihr Zweck ist es, den Prüfärzten und anderen an der Studie Beteiligten die notwendigen Informationen an die Hand zu geben, um ihnen das Verständnis der Gründe für viele wichtige Merkmale des Prüfplans und deren Einhaltung zu erleichtern. Dazu gehören die Dosis, die Dosishäufigkeit bzw. das Dosierungsintervall, die Verabreichungsmethoden und die Sicherheitsüberwachungsverfahren. Die IB enthält präklinische und klinische Informationen zu einem Prüfpräparat.

Bei der Arbeit an IBs präsentieren die Experten für klinische Etikettierung von Freyrdie Informationen in einer prägnanten, einfachen, objektiven und ausgewogenen Form. Die gleichen Qualitäten können auch bei der Übersetzung von Dokumenten berücksichtigt werden. Neben der Erstellung von IBs unterstützt Freyr auch die jährliche Überprüfung der IBs und arbeitet bei Bedarf an Überarbeitungen, in Übereinstimmung mit den von Kunden und Sponsoren festgelegten Standardverfahren.
- Entwicklung von Target LabelingTL)/Target Profile
- Entwicklung und Überprüfung von DCDS & DCSI
Freyr verfügt über ausgewiesene Fachkenntnisse bei der Erstellung hochwertiger Developmental Core Data SheetsDCDS). Das DCDS ist ein zwischengeschaltetes Kernetikett, das für die Ableitung von Inhalten für nationale Erstzulassungskennzeichnungen (wie USPI, SmPC usw.) unerlässlich ist. Das DCSI wird auf der Grundlage des Zielkennzeichens erstellt und liefert integrierte Sicherheits- und Wirksamkeitsdaten zu einer Intervention oder einem Arzneimittel. Der DCSI hilft Prüfärzten und Sponsoren durch die Darstellung und Aktualisierung gezielter und spezieller DCDS , die bequem in die IB eingefügt werden können. Das DCSI erleichtert die Entwicklung des CCSI, das später einen integralen Bestandteil des Kerndatenblatts des UnternehmensCCDS) bildet.
- Entwicklung und Überprüfung des FDA TPP) und des EU-Entwurfs für SmPC (dSmPC)
Das Zielproduktprofil (TPP)/der Entwurf der Zusammenfassung der Produktmerkmale (dSmPC) ist eine Form der klinischen Kennzeichnung, die Diskussionen zwischen Pharmaunternehmen und Gesundheitsbehörden erleichtert. Das TPP wird während des gesamten Arzneimittelentwicklungsprozesses verwendet, von der Phase vor der Beantragung einer Investigational New Drug (IND)IND und derIND-Beantragungsphase der Arzneimittelentwicklung bis hin zu Programmen nach der Markteinführung, um neue Indikationen oder andere wesentliche Änderungen in der Kennzeichnung klinischer Studien zu verfolgen. Pharmazeutische Unternehmen legen die Kennzeichnungskonzepte, die die Ziele des Arzneimittelentwicklungsprogramms darstellen, in Form von TPP fest. TPP enthält eine Erklärung zur Gesamtzielsetzung des Arzneimittelentwicklungsprogramms und liefert Informationen über das Arzneimittel in einer bestimmten Entwicklungsphase. Als strategischer Partner im Bereich der Zulassungsfragen verfügt Freyr über Fachkompetenz in der Erstellung von TPPs für die US dSmPCs für die EU.
- Ressourcen mit fundierten regulatorischen Kenntnissen im Bereich der klinischen Verpackung und Etikettierung
- Erfahrung in der erfolgreichen Bearbeitung globaler und regionaler Arzneimittelkennzeichnungen für Fortune-Pharma-Kunden in den USA, Europa, APAC, MENA, etc.
- Globale regulatorische Erfahrung bei der Unterstützung von Unternehmen der Biowissenschaften, d.h. Pharma-, Biotech- und Nahrungsmittelhersteller
- Hochqualifizierte medizinische Redakteure mit umfassender Erfahrung in der Kennzeichnungspflicht
- Eingehende und aktuelle Kenntnisse der weltweiten Änderungen der Arzneimittelkennzeichnung durch verschiedene Gesundheitsbehörden wie die USFDA, EMA, TGA usw.
- Spezielles Compliance-Team, das den Stand der Umsetzung des Kerndatenblatts und des Unternehmens-KerndatenblattsCDSCCDS) in den regionalen Etiketten verfolgt
- Fachwissen über die Kennzeichnung von klinischen Studien und klinische Kennzeichnungsdienste
- Hochgradig erfahrene Fachleute für die Kennzeichnung von Pharmazeutika, Biotechnologie und Nahrungsmitteln





