SaMD in den US Überblick
Antworten auf dieser Seite
- Ist meine Software eine SaMD?
- Für welche Risikoklasse von SaMD ist eine 510(k)-Anmeldung erforderlich?
- SaMD und Konformität - das 510(k)-Verfahren
- Wie lange ist die Freigabe gültig?
Ist meine Software eine SaMD?
Nach Angaben des International Medical Device Regulators Forum (IMDRF) ist SaMD ein:
- Software, die für einen oder mehrere medizinische Zwecke verwendet werden soll.
- Erfüllt diese Zwecke, ohne Teil eines medizinischen Geräts zu sein.
Für welche Risikoklasse von SaMD ist eine 510(k)-Anmeldung erforderlich?
Die Bestimmung der SaMD für Ihre Software ist ein wichtiger Schritt im Registrierungsprozess. Sobald Ihre Software als SaMD klassifiziert wurde, ist es unerlässlich, den regulatorischen Weg zu verstehen, der für den Markteintritt in den US erforderlich ist. SaMD in der Regel anhand ihres Risikograds in verschiedene Klassen eingeteilt. SaMD der Klasse II SaMD mäßig risikobehaftet, erfordern eine 510(k)-Zulassung und müssen eine wesentliche Gleichwertigkeit mit dem rechtmäßig vermarkteten Referenzprodukt nachweisen. Der Zulassungsprozess stellt sicher, dass Ihre SaMD im Wesentlichen mit bestehenden Produkten gleichwertig SaMD , was dazu beiträgt, ihre Sicherheit und Wirksamkeit vor der Vermarktung zu gewährleisten.
SaMD und Konformität - das 510(k)-Verfahren
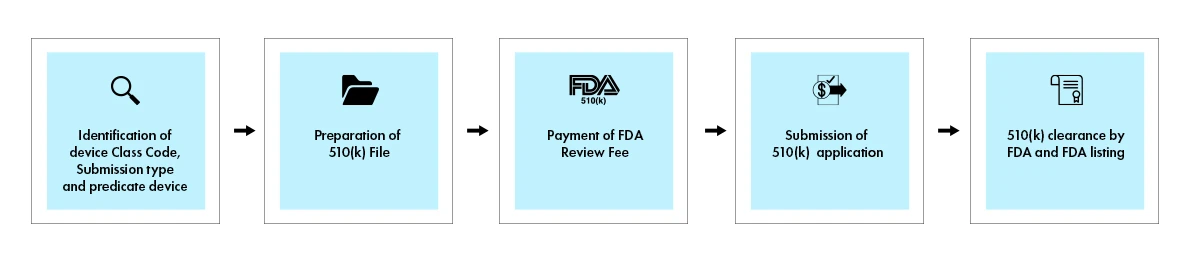
Das 510(k)-Verfahren umfasst eine umfassende Einreichung, die die wesentliche Gleichwertigkeit mit einem rechtmäßig vermarkteten Referenzprodukt nachweist. Wenn eine Entscheidung getroffen wurde, sendet die US and Drug Administration (FDA) dem Antragsteller per E-Mail einen Bescheid zu. Ein 510(k)-Antrag, für den ein Bescheid über die wesentliche Gleichwertigkeit erteilt wird, gilt als „genehmigt”. Er wird dann in die 510(k)-Datenbank aufgenommen, wobei die 510(k)-Zusammenfassung beigefügt wird. Die folgende Abbildung gibt einen visuellen Überblick über die wichtigsten Schritte des 510(k)-Verfahrens.
Wie lange ist die Freigabe gültig?
Eine 510(k)-Zulassung bleibt gültig, bis wesentliche Änderungen am Produkt oder den geltenden Vorschriften vorgenommen werden. Es ist jedoch zu beachten, dass die US FDA regelmäßig Berichte oder zusätzliche Informationen anfordernFDA , um die fortlaufende Konformität und Sicherheit sicherzustellen.
Zusammenfassend lässt sich sagen, dass die SaMD ein gründliches Verständnis der SaMD , der SaMD und der regulatorischen Prozesse erfordert. Die Inanspruchnahme von SaMD kann eine fachkundige Anleitung zur Bewältigung der komplexen Zusammenhänge und zur Sicherstellung eines erfolgreichen Registrierungsergebnisses bieten.
SaMD in den US
- Umfassende US FDA Regulierungsstrategie für SaMD.
- SaMD .
- Prädikat Geräteidentifikation.
- Feststellung der wesentlichen Gleichwertigkeit mit der Prädikatsextraktion.
- Lückenanalyse zurFDA US FDA .
- Zusammenstellung der technischen Unterlagen gemäß 510(k) gemäß den LeitlinienFDA US FDAfür die Einreichung von Software vor der Markteinführung.
- Erstellung der eCopy/eSTAR-Vorlage.
- Validierung und Einreichung der eCopy/eSTAR-Vorlage.
- Kontakt zu den Dienststellen für die Zulassung von Produkten.
- Unterstützung bei RTA-Reaktionen und AINN-Mängeln.
- Beratungsdienste zur Beseitigung von Mängeln.
- Registrierung der Einrichtung bei der US FDA.
- Auflistung der Geräte und Pflege der FURLS-Datenbank.
- Dienstleistungen von Rechtsvertretern (LR).

- Umfassende Erfahrung mit verschiedenen 510(k)-Registrierungen.
- Fachwissen im Bereich der 510(k)-Zusammenstellung gemäß den AnforderungenFDA US FDAfür die Premarket Notification (510[k]).
- Zusätzliche Unterstützung bei der Bearbeitung von 510(k)-Anfragen.
- Pünktliche Einreichung der Arbeitsergebnisse.
- Auf dem neuesten Stand der neuen ÄnderungenFDA US FDAzu SaMD.





