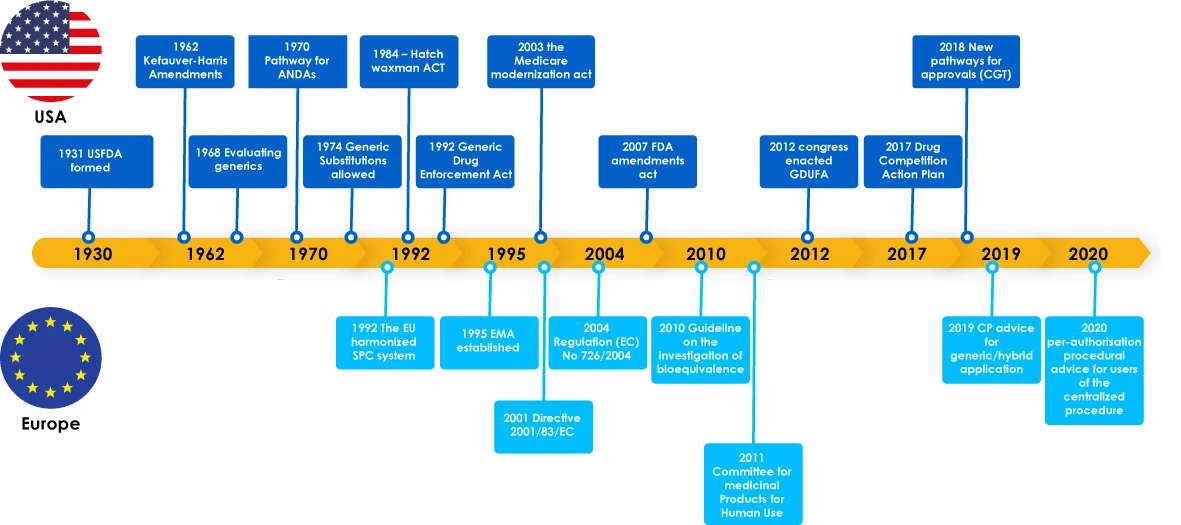
Entwicklung der Generika - Überblick
Zu den wichtigsten Meilensteinen bei der Entwicklung von Generika gehörten Gesetze zur Förderung der Entwicklung von Generika, die die Hersteller ermutigten, den Generikamarkt zu erschließen. Diese Gesetze verschafften den Ärzten auch das Vertrauen, einen Ersatz für ein Markenmedikament zu verschreiben, was schließlich den Patienten zugute kam, da die Generikahersteller den kritischen Bedarf der Patienten auf der ganzen Welt deckten.
FAQs zu Generika
F1: Was sind Generika?
Antwort: Generika sind Arzneimittel, die identische Kopien des Originalpräparats sind und den gleichen Wirkstoff, die gleiche Dosierung, den gleichen Verwendungszweck, die gleichen Nebenwirkungen, den gleichen Verabreichungsweg, die gleichen Risiken, die gleiche Sicherheit und die gleiche Stärke wie das Originalpräparat haben, sich aber in einigen Merkmalen wie Herstellungsprozess, Formulierung, Hilfsstoffe, Farbe, Geschmack und Verpackung unterscheiden können. Mit anderen Worten: Ein Generikum ist therapeutisch gleichwertig mit einem Markenarzneimittel und kann daher durch sein Markenmedikament ersetzt werden.
F2: Warum kosten Generika weniger als ein innovatives Medikament?
Antwort: Generika sind im Vergleich zu innovativen Arzneimitteln kostengünstiger, da sie nicht die kostspieligen und langwierigen präklinischen und klinischen Studien wiederholen müssen, die für innovative Arzneimittel erforderlich sind, um ihre Sicherheit und Wirksamkeit nachzuweisen; stattdessen müssen Generika nur die pharmazeutische Gleichwertigkeit ihres Produkts nachweisen.
F3: Sind Generika genauso gut wie innovative Arzneimittel?
Antwort: Ja, Generika haben die gleiche Qualität, Wirksamkeit und Sicherheit wie Markenarzneimittel. Der niedrigere Preis dieser Medikamente bedeutet nicht, dass sie von minderer Qualität sind, denn Generika müssen genau wie Markenmedikamente ein strenges Zulassungsverfahren durchlaufen, um auf den Markt gebracht werden zu können, und die Pharmaunternehmen müssen einen Antrag für ein Generikum einreichen, aus dem hervorgeht, dass ihr Medikament denselben klinischen Nutzen hat wie die Markenmedikamente und als Ersatz für das jeweilige Markenmedikament verwendet werden kann.
F4: Warum sehen Generika anders aus als Markenarzneimittel?
Antwort: Generische Arzneimittel müssen mit Markenarzneimitteln bioäquivalent sein und denselben Wirkstoff wie innovative Arzneimittel enthalten. Es kann jedoch geringfügige Unterschiede bei den generischen Arzneimitteln in Bezug auf Form, Etikettierung (geringfügige Unterschiede), Verpackung und inaktive Bestandteile wie Farb-, Geschmacks- und Konservierungsstoffe geben; die Wirksamkeit des Arzneimittels muss jedoch dieselbe bleiben.
Frage 5: Was ist bei der Prüfung und Genehmigung von Anträgen für Generika in den US zu beachten?
Antwort: Jedes Pharmaunternehmen, das sein Generikum in den US vermarkten möchte, US alle regulatorischen AnforderungenFDA US FDAfür die Zulassung von Generika erfüllen und nachweisen, dass:
- Das Generikum ist "pharmazeutisch/therapeutisch gleichwertig" mit dem Markenarzneimittel
- Der Hersteller ist in der Lage, das Medikament korrekt und konsistent herzustellen.
- Der "Wirkstoff" ist der gleiche wie der der Marke
- Die richtige Menge des Wirkstoffs gelangt an den Ort im Körper, an dem er wirkt
- Die "inaktiven" Bestandteile des Medikaments sind sicher
- Das Medikament wird nicht mit der Zeit abgebaut
- Das Behältnis, in dem das Arzneimittel versandt und verkauft werden soll, ist geeignet
- Das Etikett ist dasselbe wie das Etikett des Markenmedikaments
- Einschlägige Patente oder gesetzliche Exklusivitätsrechte sind ausgelaufen
F6: Gibt es für jedes Markenmedikament ein Generikum?
Antwort: Nein. Es gibt nicht für jedes Markenmedikament eine generische Version. Neue Medikamente werden unter Patentschutz für bis zu zwanzig (20) Jahre hergestellt. Das bedeutet, dass während dieses Zeitraums bis zum Ablauf des Patents kein anderes Medikament hergestellt und vermarktet werden darf. Bei einigen Arzneimitteln kann es jedoch vorkommen, dass es nie eine generische Version gibt, weil die Herstellung schwierig ist oder sich das generische Produkt als unrentabel erweisen könnte.




