Überblick über die Registrierung von Medizinprodukten in Großbritannien
Auch nach dem Brexit ändert und ergänzt das Vereinigte Königreich seine Vorschriften für Medizinprodukte. Die im Land zu befolgenden Vorschriften sind geografisch aufgeteilt - Großbritannien (GB) und Nordirland (NI). Die MHRA(Medicines and Healthcare Products Regulatory Agency) ist die Regulierungsbehörde, die sich um Medizinprodukte kümmert. Nordirland muss die Medizinprodukteverordnung der Europäischen Union (EU MDR) 2017/745 und die Verordnung über In-vitro-Diagnostika (IVDR) 2017/746 einhalten. Hersteller, die nicht aus dem Vereinigten Königreich stammen, müssen eine verantwortliche Person aus dem Vereinigten Königreich (UK RP) benennen, die sie bei der Einhaltung dieser Vorschriften unterstützt und ein erfolgreiches Registrierungsverfahren für Medizinprodukte im Vereinigten Königreich gewährleistet.
Regulierungsbehörde: Aufsichtsbehörde für Arzneimittel und GesundheitsprodukteMHRA)
Verordnung: Medizinprodukteverordnung (MDR) 2002*
Regulierungspfad: CE-Kennzeichnung gefolgt von Notifizierung
Bevollmächtigter Vertreter: UK Responsible Person (UK RP) für nicht britische Hersteller
QMS-Anforderung: ISO 13485:2016
Bewertung der technischen Daten: UK Zugelassene Stellen für die UKCA-Kennzeichnung
Gültige Markierungen: GB - UKCA oder CE & NI - CE oder CE + UKNI
Format der Einreichung: Papier
Format der Einreichung: Online
*Künftige Verordnungen für Medizinprodukte gelten ab 1. Juli 2025
Die britische Klassifizierung von Medizinprodukten
Die Klassifizierung von Medizinprodukten im Vereinigten Königreich basiert auf der britischen MDR 2002. Die Klassifizierung des Produkts ist der allererste Schritt im gesamten Prozess der Zulassung und Markteinführung des Produkts.
Klassifizierung von Medizinprodukten
| Klasse | Risiko |
|---|---|
| Klasse I | Niedrig |
| Klasse IIa | Mittel |
| Klasse IIb | Mittel |
| Klasse III | Hoch |
IVD-Klassifizierung
- Allgemeines IVD
- IVDs zur Eigenanwendung
- IVDs, die unter Anhang II Liste A fallen
- IVDs, die unter Anhang II Liste B fallen
Unser Unternehmen ist auf die Klassifizierung von Medizinprodukten spezialisiert. Bis heute hat Freyr die Klassifizierung von Medizinprodukten für über 50 Unternehmen in Großbritannien erfolgreich abgeschlossen.
Verantwortliche Person des Vereinigten Königreichs (UKRP) Dienstleistungen
Hersteller, die nicht aus dem Vereinigten Königreich stammen, sind nun verpflichtet, UKRP zu benennen, um ihre Produkte auf den Markt zu bringen.
Freyr hat sich erfolgreich registriert und kann nun als Ihr UKRP fungieren. Weitere Einzelheiten zu unseren UKRP-Diensten finden Sie unter www.ukrpservices.com
Registrierung von Medizinprodukten
Die Hersteller müssen nun eine vom Vereinigten Königreich zugelassene Stelle beauftragen, um die UKCA-Kennzeichnung zu erhalten. Die CE-Kennzeichnung ist zwar zulässig, gilt aber nur für einen bestimmten Zeitraum. Die Übergangsfristen dafür sind unten aufgeführt.
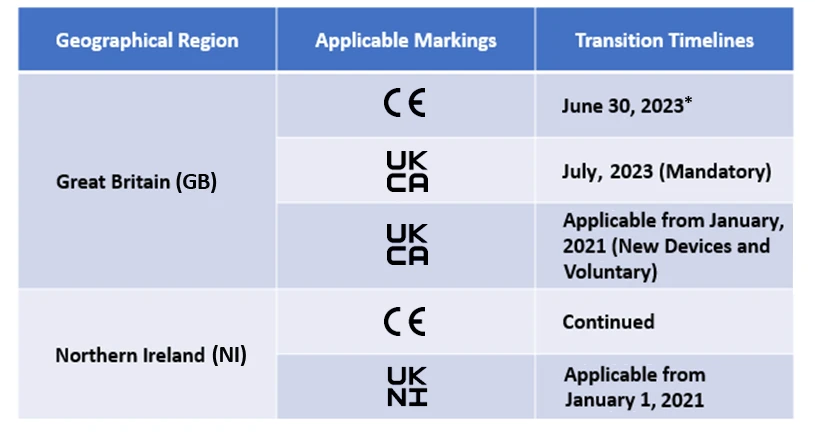
Freyr unterstützt derzeit viele Hersteller bei den Übergängen nach dem Brexit.
*Die derzeitige Übergangsfrist für die CE-Kennzeichnung gemäß EU MDR IVDR wird von der britischen MHRA anerkannt, und die Fristen sind je nach Anwendungsbereich der Produkte unterschiedlich.
Anforderungen an die Überwachung nach dem Inverkehrbringen
Die Anforderungen an die Überwachung nach dem Inverkehrbringen gemäß der britischen MDR 2002 sind recht streng, um die Sicherheit und Wirksamkeit für Patienten/Anwender zu gewährleisten. Zu den PMS-Aktivitäten gehört derzeit die Meldung von Zwischenfällen/Funden an die MHRA. Die MHRA hat dazu einen umfassenden Leitfaden herausgegeben.
UK Registrierung von Medizinprodukten
Freyr-Podcasts
- UK-Klassifizierung von Medizinprodukten
- Unterstützung beim Übergang zur Regulierung nach dem Brexit
- Regulatorische Unterstützung für UK MHRA Notifizierung
- Verantwortliche Person im Vereinigten Königreich (UKRP)
- Kontaktaufnahme und Unterstützung durch die Gesundheitsagentur und die zugelassene Stelle