Übersicht über Kombinationsprodukte für medizinische Geräte
In der dynamischen Welt des Gesundheitswesens und der Innovation sind Kombinationsprodukte für Medizinprodukte zu einer robusten Brücke zwischen Arzneimitteln, Medizinprodukten und Biologika geworden. Der Markt für Kombinationsprodukte ist mit einer erwarteten jährlichen Wachstumsrate (CAGR) von 8,9 % zwischen 2023 und 2030 auf einem guten Weg. Der Sektor für Kombinationsprodukte aus Arzneimitteln und Medizinprodukten ist für ein nachhaltiges Wachstum bereit, das durch technologische Fortschritte, eine verbesserte Gesundheitsinfrastruktur, reibungslosere Zulassungswege, strategische Kooperationen und das Engagement für eine patientenorientierte Versorgung begünstigt wird.
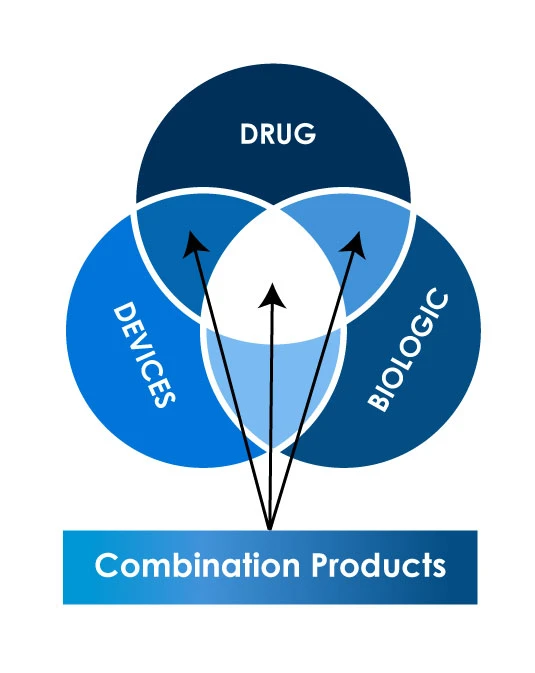
Verschiedene Arten von Kombinationsprodukten
Globales Regulierungsszenario für die Zulassung von Kombinationsprodukten
Die Auslegung dessen, was ein Kombinationsprodukt ist, kann von Land zu Land unterschiedlich sein, was die Registrierung solcher Produkte in verschiedenen Ländern noch komplexer macht. Darüber hinaus können die behördlichen Anforderungen und Verfahren für Kombinationsprodukte Unterschiede in der Dokumentation, Kommunikation und Validierung aufweisen. Das regulatorische Umfeld für die Registrierung von Kombinationsprodukten kann sich weltweit erheblich unterscheiden. Hier sind die wichtigsten Zulassungsbehörden, die diese Produkte weltweit überwachen.
| Land | Agentur | Leitende Zentren für die Zulassung |
|---|---|---|
| USA | Amt für Kombinationsprodukte (OCP) | Zentrum für Arzneimittelevaluierung und -forschung (CDER) |
| Zentrum für Biologika-Bewertung und -Forschung (CBER) | ||
| Zentrum für Geräte und Radiologische Gesundheit (CDRH) | ||
| EU | Benannte Stellen (NBs) | Zuständige nationale Behörde (Arzneimittel) |
| Benannte Stellen (NBs) (Medizinprodukte) | ||
| Japan | Abteilung Evaluierung und Lizenzierung oder das Büro für Medizinprodukte/Zell- und Gewebeprodukte des Büros für Arzneimittel- und Lebensmittelsicherheit | Direktor der Bewertungs- und Zulassungsabteilung (DMDL), Büro für Pharmazeutische und Lebensmittelsicherheit, Büro für Pharmazeutische und Medizinische Sicherheit, Ministerium für Gesundheit und Wohlfahrt |
| China | Zentrum für die Verwaltung der Normung medizinischer Geräte (CMDSA) | Zentrum für die Bewertung von Medizinprodukten (CMDE) |
| Zentrum für Arzneimittelbewertung (CDE) | ||
| Malaysia | Nationale Arzneimittelzulassungsbehörde | Nationale pharmazeutische AufsichtsbehördeNPRA) |
| Agentur für Medizinprodukte |
Die Registrierung von Kombinationsprodukten auf den internationalen Märkten erfordert einen maßgeschneiderten Ansatz, der eine enge Zusammenarbeit mit den für die Zulassung zuständigen Gesundheitsbehörden beinhaltet. Das typische Verfahren für die Registrierung von Kombinationsprodukten umfasst die folgenden Schritte:
- Beurteilung, ob ein bestimmtes Produkt die Kriterien für die Einstufung als Kombinationsprodukt erfüllt.
- Kategorisierung der Geräte auf der Grundlage der damit verbundenen Risiken.
- Identifizierung der relevanten Standards und Datenvoraussetzungen, die von der jeweiligen Gesundheitsbehörde vorgegeben werden.
- Generierung der erforderlichen Daten gemäß den Vorgaben der Agentur.
- Erstellung eines technischen Dossiers gemäß den spezifischen Anforderungen des jeweiligen Landes.
- Einreichung des Antrags und Beantwortung aller Fragen und Bedenken bis zur Genehmigung.
- Verwaltung des Lebenszyklus des Produkts nach der Zulassung.
Unsere Zuständigkeiten
- Erste Risikoanalyse
- Marktforschung - Produktspezifische Markteinblicke
- Aufstockung des Personals
- Entwurf einer Regulierungsstrategie
- Potenzielle Märkte und Routen
- Entwurfsunterlagen und Risikoanalyse
- Quality Management System (QMS) ISO 13485
- Medical Device Single Audit Program MDSAP)
- QMS ISO 13485 Vorbewertung
- Regulatorische Strategie
- Freyr IMPACT (Plattform für aufsichtsrechtliche Informationen)
- Entwurfsüberprüfung und -validierung
- Risikomanagement
- Entwurf der technischen Dokumentation
- Regulatorische Strategie
- Regulatorische Anforderungen
- Freyr rDMS-Tool (Daten-/Dokumentationsverwaltungssystem)
- Prozess- und klinische Validierung
- Endgültige Beschriftung und artwork
- Vertretung im Land
- Regulierungsvorlage
- Die Conformité Européenne" (CE)-Kennzeichnung der Europäischen Union (EU) und die UK Conformity Assessment (UKCA)-Kennzeichnung
- Zertifizierung des globalen Marktzugangs
- Unterstützung bei Audits durch benannte Stellen (NB)/zugelassene Stellen
- Vertretung im Land
- Regulatorische Genehmigungen
- Post-market Surveillance (PMS)
- Klinische Nachbeobachtung nach der Markteinführung (PMCF)
- Jährliche Pflege der technischen Unterlagen (CER/Risikomanagement)
- Gesetzliche Verlängerungen
- Neue Markteinführungen
- Mitteilung der zuständigen Behörde/notifizierten/zugelassenen Stelle
- Automatisierte Lösungen für die Pharmakovigilanz (PV)
Warum Freyr?
Registrierung von Medizinprodukten
- Umfassende Zulassungsstrategie für Kombinationsprodukte.
- Regulatorische Unterstützung für Produktentwicklungsdokumente wie Design History Files (DHFs).
- Strategie zur Einhaltung des QMS.
- Einhaltung von Vorschriften, Lückenanalyse und Behebung von Mängeln in technischen Dokumenten und Qualitätssystemen.
- Dienstleistungen im Bereich Kennzeichnung und technisches Schreiben.
- Regulierungs- und Marktinformationsdienste.
- Übersetzungsdienste für Dokumente und Beschriftungen.
- Kontaktaufnahme mit der Gesundheitsagentur und Dienst.
- artwork regulatorischen artwork .
- Pharmakovigilanz und PMS-Dienste.
- Veröffentlichungsdienste.
- Medizinische Schreibdienste.

- Erfolgreiche Einreichungen für verschiedene Klassen von IVDs.
- Engagiertes und fachkundiges Personal für die Unterstützung bei der Zulassung von Medizinprodukten und IVD.
- Pünktliche Einreichung der Arbeitsergebnisse.
- Zugang zu lokalen Tochtergesellschaften, um den Herausforderungen der Behörde und den sprachspezifischen Anforderungen gerecht zu werden.
- Unterstützung vor Ort oder durch Rechtsvertreter mit einem kostengünstigen Modell.
- Verwaltung von Ressourcen für die Regulierung/Personalaufstockung.





