Software as a Medical Device SaMD) Überblick
Software as a Medical Device SaMD) ist das neueste Boomthema im Gesundheitswesen. Es wird erwartet, dass der SaMD weltweit mit einer durchschnittlichen jährlichen Wachstumsrate (CAGR) von 10,78 % wächst. Dieses Wachstum wird durch verschiedene Faktoren ausgelöst, wie z. B. die Einführung des Internets der Dinge (IoT), die digitalen Gesundheitsplattformen und die Einführung von Software zur kontinuierlichen Überwachung physiologischer Parameter durch Gesundheitsdienstleister zur Fernunterstützung. Diese vielversprechende Landschaft bringt jedoch auch einzigartige Herausforderungen mit sich. Eine davon ist die Bestimmung, ob das Produkt in die Kategorie der Medizinprodukte fällt und den gesetzlichen Anforderungen entspricht.
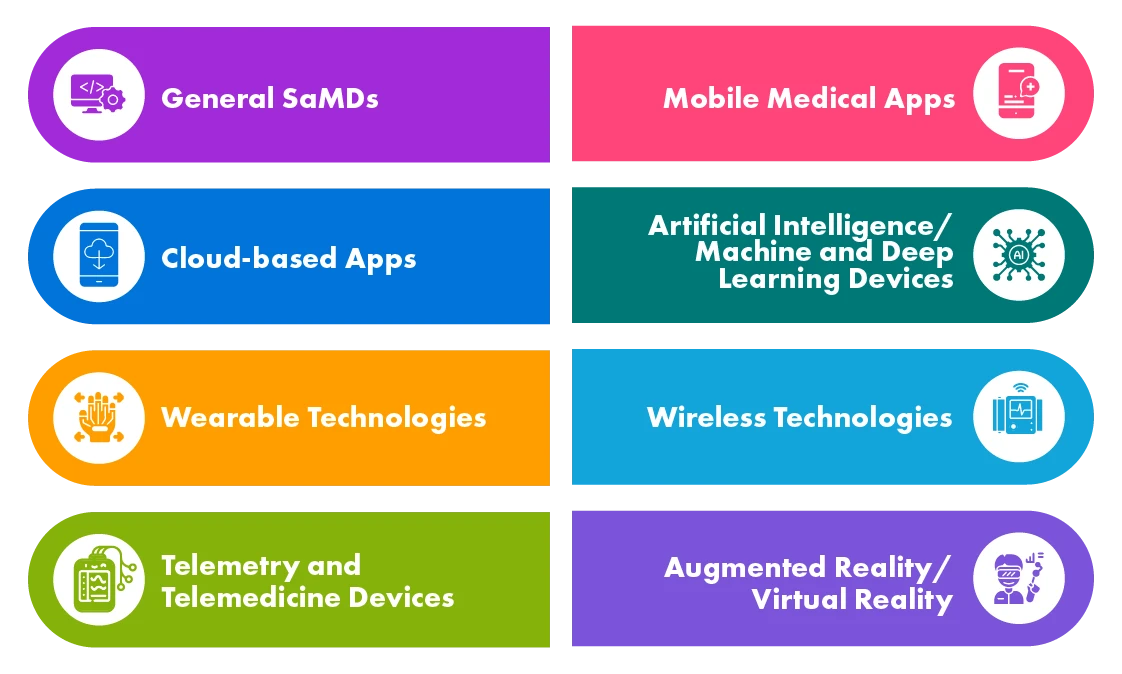
Verschiedene Arten von digitalen Gesundheitsprodukten
Globales Regulierungsszenario für die Registrierung von Software as a Medical Device SaMD)
SaMDs werden in verschiedenen Anwendungsbereichen eingesetzt, beispielsweise bei der Vorsorgeuntersuchung und Diagnose, Überwachung und Alarmierung, Krankheitsbehandlung usw. Die Gesundheitsbehörden der Industrieländer wie der EU, der US, Kanadas und Australiens haben Vorschriften für SaMDs festgelegt, und einige von ihnen haben bereits Leitfäden entwickelt, während andere noch dabei sind.
Einige regulierte und nicht regulierte Märkte betrachten Software als Medizinprodukte, haben aber keine differenzierten und spezifischen Richtlinien für die Klassifizierung von Software as a Medical Device SaMD). Sie folgen den international anerkannten harmonisierten Richtlinien für die Bewertung und Zulassung von Software.
Nachfolgend sind einige der wichtigsten Leitlinien zur Registrierung von Software as a Medical Device SaMD) aufgeführt:
- IMDRF-Leitfaden für Klassifizierung, Quality Management System (QMS), Bewertung der Cybersicherheit und klinische Bewertung.
- Die EU MDR 2017/745 hat die regulatorischen Anforderungen und Leitlinien für diese Produktkategorie detailliert beschrieben.
- Die MDCG-Leitlinien zur Qualifizierung und Klassifizierung von SaMD, die Anforderungen an Clinical Evaluation Reports (CER)/Leistungsbewertungsberichte (PER) für SaMD.
- FDA US FDA zu Cybersicherheit, klinischer Bewertung und Zulassungsanforderungen für verschiedene Arten von Software, wie Entscheidungssysteme, Bildarchivierungs- und Kommunikationssysteme (PACS), mobile Anwendungen usw.
- Leitfaden Health Canada zur Definition und Klassifizierung von SaMD .
- Die neuen Vorschriften der TGA für softwarebasierte Medizinprodukte.
Die Zulassung von SaMD auf anderen globalen Märkten wird von Fall zu Fall gehandhabt und erfordert eine enge Zusammenarbeit mit der jeweiligen Gesundheitsbehörde, um eine Genehmigung zu erhalten. Der allgemeine Weg zur Registrierung von SaMD umfasst folgende Schritte:
- Feststellung, ob eine bestimmte Software als SaMD eingestuft werden kann.
- Einstufung der Produkte nach ihrem Risiko.
- Ermittlung der geltenden Normen und Datenanforderungen der betreffenden Gesundheitsbehörde.
- Generierung von Daten gemäß den Anforderungen der jeweiligen Agentur.
- Zusammenstellung der technischen Unterlagen gemäß den Anforderungen des Landes.
- Einreichung und Beantwortung von Anfragen bis zur Genehmigung.
- Management des Lebenszyklus nach der Zulassung.
Unsere Zuständigkeiten
- Regulatory Intelligence Services (Markt- und Kennzeichnungsunterstützung)
- Regulatorische Due Diligence / Strategieberichte
- Qualifizierung und Klassifizierung von SaMD
- Produktklassifizierung Anwendung auf die BS
- Lückenanalyse
- Treffen mit der FDA vor der Einreichung
- Identifizierung der anwendbaren Normen
- Aktivitäten zum Risikomanagement
- Unterstützung des Risikomanagements
- Unterstützung bei der Etikettierung
- Erstellung/Überprüfung/Aktualisierung von SaMD Verfahren/Vorlagen
- UDI/ GUDID
- Produktregistrierung (Software-Registrierung)
- Registrierung von Betrieben
- Geräteauflistung
- HA SaMD
Warum Freyr?
Häufig gestellte Fragen (FAQs)
Die Regulierung medizinischer Software wird von verschiedenen globalen Regulierungsbehörden überwacht, darunter die FDA in den Vereinigten Staaten, die EMA in Europa und die PMDA in Japan. Diese Behörden klassifizieren medizinische Software auf der Grundlage des Risikos und legen Richtlinien für Sicherheit, Qualität und Wirksamkeit fest. Die Einhaltung von ISO-Normen wie ISO 13485 und 62304 ist erforderlich.
Bei der Bestimmung der Risikoklassifizierung von Software as a Medical Device SaMD) werden Faktoren wie die beabsichtigte Verwendung und der potenzielle Schaden bewertet. SaMDs werden wie herkömmliche Medizinprodukte auf der Grundlage der Bedeutung der bereitgestellten Informationen für Entscheidungen im Gesundheitswesen und des Zustands der Gesundheitssituation oder des Gesundheitszustands als nicht ernst, ernst und kritisch eingestuft. Regulierungsrichtlinien und die Beratung durch Experten sind in diesem Prozess von entscheidender Bedeutung, um die Einhaltung der Vorschriften und die Sicherheit der Patienten zu gewährleisten.
SaMD bezieht sich auf Software, die für einen oder mehrere medizinische Zwecke verwendet werden soll, ohne Teil eines physischen medizinischen Geräts zu sein. Sie läuft auf allgemeinen Computerplattformen wie Smartphones, Tablets oder Personalcomputern. Im Gegensatz dazu ist SiMD eine Software, die integraler Bestandteil eines physischen medizinischen Geräts ist und zu dessen Funktionalität und Leistung beiträgt. SiMD kann nicht unabhängig verwendet werden und ist auf das zugehörige Medizinprodukt angewiesen, um den beabsichtigten Zweck zu erfüllen.
Eine Software, die als Teil eines Hardware-Medizinprodukts eingebettet ist und für den beabsichtigten medizinischen Zweck erforderlich ist, gilt NICHT als SaMD.
Der Zeitplan für die Einhaltung der SaMD hängt von der Risikoklasse und den behördlichen Anforderungen ab. Mit der richtigen Unterstützung durch die Aufsichtsbehörden können Sie jedoch einen reibungsloseren Konformitätsprozess mit minimalen Risiken gewährleisten.
Registrierung von Medizinprodukten
- Umfassende Regulierungsstrategie für SaMDs.
- Unterstützung bei der Regulierung und Marktbeobachtung.
- Produktklassifizierungs- und Registrierungsdienste für SaMDs.
- Regulatorische Unterstützung für SaMD Produktentwicklungsdokumente.
- Beratungsdienste zu klinischen Evaluierungsstudien SaMD .
- Änderungsmanagement nach der Zulassung.
- Lokaler Vertretungsdienst.

- Umfassende Regulierungsstrategie für SaMDs.
- Unterstützung bei der Regulierung und Marktbeobachtung.
- Produktklassifizierungs- und Registrierungsdienste für SaMDs.
- Regulatorische Unterstützung für SaMD Produktentwicklungsdokumente.
- Beratungsdienste zu klinischen Evaluierungsstudien SaMD .
- Änderungsmanagement nach der Zulassung.
- Lokaler Vertretungsdienst.





