Medical Device Licence (MDL) Lösungen für Kanada Übersicht
Eine Medical Device Licence (MDL) ist ein von Health Canada (HC) ausgestelltes Dokument, das Hersteller dazu berechtigt, Medizinprodukte der Klassen II, III oder IV in Kanada einzuführen oder zu verkaufen. Die Lizenz gewährleistet, dass die Geräte die erforderlichen Sicherheits-, Qualitäts- und Wirksamkeitsstandards gemäß den Medizinproduktevorschriften erfüllen.
Who braucht eine MDL?
Hersteller von Medizinprodukten der Klassen II, III und IV, die auf den kanadischen Markt importiert/verkauft werden sollen, müssen eine MDL beantragen.
Voraussetzungen für die Erteilung einer MDL:
Die Hersteller müssen die Medical Device Regulations (MDR) von Health Canada einhalten, um eine MDL zu erhalten.
- Alle Hersteller von Produkten der Klassen II, III und IV müssen über ein ISO 13485:2016-Zertifikat im Rahmen des Medical Device Single Audit Program MDSAP) verfügen. Damit wird die Einhaltung der Anforderungen an Quality Management System (QMS) nachgewiesen, um eine von Health Canada Health Canada autorisierte Konformitätsbewertungsstelle (CAB) zu erhalten, die eine Voraussetzung für die Beantragung einer MDL ist.
- Für jedes Produkt der Klassen II, III oder IV muss ein MDL-Antragsformular bei Health Canada eingereicht werden.
- Die Handelsmarkenhersteller können eine MDL erst beantragen, wenn der Originalhersteller eine MDL erhalten hat.
- Das Antragsformular für Private Labeling unterscheidet sich von dem der Originalhersteller.
Optimieren Sie Ihren Zulassungsprozess für Medizinprodukte mit unserer fachkundigen Unterstützung. Wenden Sie sich noch heute an die Spezialisten von Freyr, um sicherzustellen, dass Ihr Medizinprodukt alle behördlichen Anforderungen erfüllt und einen rechtzeitigen Marktzugang in Kanada erhält.
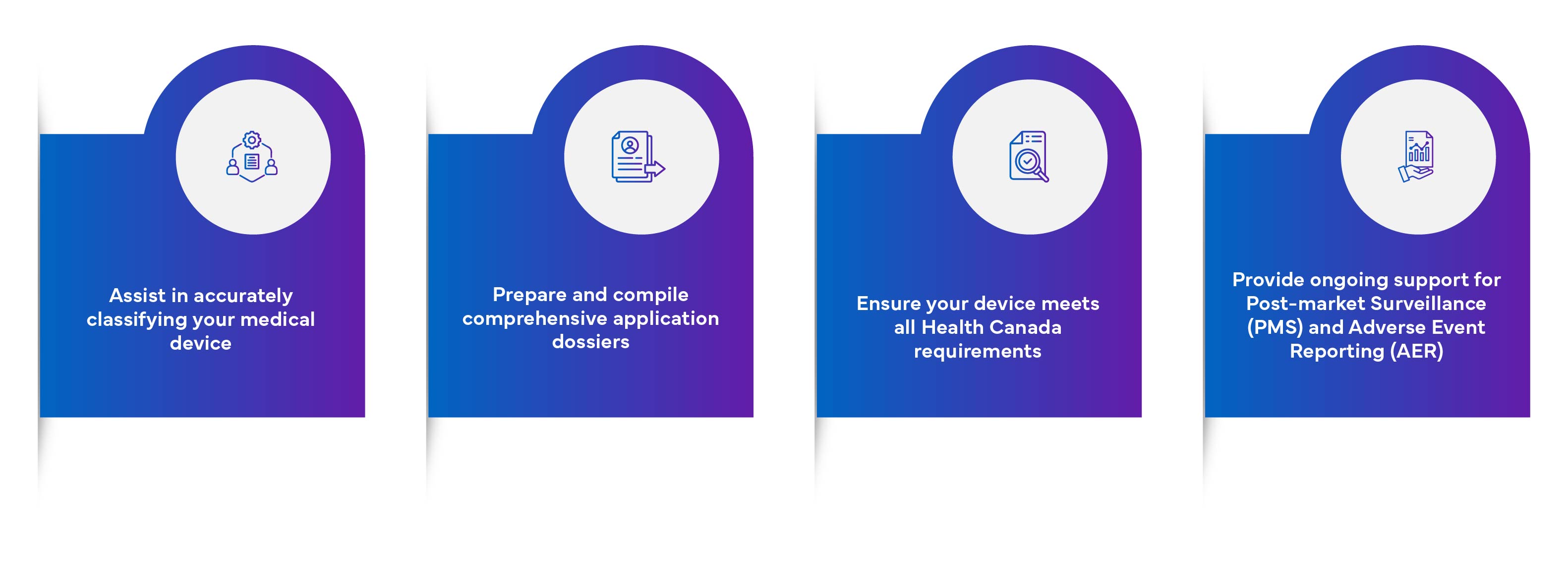
Freyr Medical Device Licence (MDL)-Kompetenzen:
![]()
Klassifizierungs- und Gruppierungsdienste für Medizinprodukte Health Canada .![]()
Überprüfung und Zusammenstellung einer Lückenanalyse der Ausgangsdokumente.![]()
Zusammenstellung und Überprüfung des technischen Dossiers.![]()
Vorbereitung des Antrags auf eine Lizenz für Medizinprodukte (MDL).![]()
Etikettierungsdienste gemäß den Health Canada für Medizinprodukte.![]()
Überprüfung der Etikettierungsunterlagen.![]()
Einreichung und Interaktion mit Health Canada zur Genehmigung des Produkts.![]()
Medical Device Single Audit Program MDSAP).
Häufig gestellte Fragen (FAQs)
Um eine Lizenz für Medizinprodukte (MDL) zu erhalten, müssen Sie einen Antrag bei Health Canada stellen. Dieser Antrag muss umfassende Informationen über das Medizinprodukt, seinen Verwendungszweck und unterstützende Unterlagen enthalten. Zu den wesentlichen Unterlagen gehören in der Regel klinische Daten, Ergebnisse von Sicherheitstests und die Zertifizierung des Quality Management System (QMS).
Wenn Sie eine bestehende Lizenz für Medizinprodukte (MDL) besitzen und Änderungen an der Adresse oder andere wesentliche Änderungen melden müssen, müssen Sie Health Canada darüber informieren. Dies geschieht durch Einreichen eines Änderungsformulars zusammen mit einer Zusammenfassung der Änderungen gegenüber den ursprünglich genehmigten Angaben.
Um eine Lizenz für Medizinprodukte (Medical Device Licence, MDL) zu beantragen, müssen Unternehmen nachweisen, dass sie über ein Quality Management System (QMS) ) verfügen, das nach ISO 13485: 2016 durch das Medical Device Single Audit Program MDSAP) zertifiziert ist. Dieses System muss den spezifischen Standards entsprechen, die in den kanadischen Vorschriften für Medizinprodukte (CMDR) festgelegt sind.
Beratung zur Regulierung von Medizinprodukten - Bewährte Expertise
Warum Freyr?