
In der sich ständig weiterentwickelnden Welt der Medizinprodukte ist die Einhaltung der Vorschriften keine einmalige Aufgabe - sie ist eine ständige Verpflichtung. Die kontinuierliche Überwachung und Aktualisierung wichtiger Berichte wie Clinical Evaluation Reports (CERs), Performance Evaluation Reports (PERs) und Periodic Safety Update Reports (PSURs) ist während des gesamten Lebenszyklus eines Medizinprodukts von entscheidender Bedeutung - von der anfänglichen Forschung bis zur Überwachung nach der Markteinführung. Da sich die Landschaft des medizinischen Fortschritts und die behördlichen Anforderungen ständig weiterentwickeln, ist die Gewährleistung der Sicherheit und Konformität von Medizinprodukten und IVDs durch eine effektive medizinische Dokumentation weiterhin der Grundstein für Erfolg und langfristige Rentabilität.
Sehen wir uns an, wie das Lebenszyklusmanagement für den Erfolg eines Medizinprodukts entscheidend bleibt
Die Markteinführung eines Medizinprodukts ist der Höhepunkt jahrelanger Bemühungen in verschiedenen Phasen wie Forschung, Entwicklung, klinische Versuche, Zulassungsanträge und Überwachung nach dem Inverkehrbringen. Dieser Prozess erstreckt sich über viele Jahre, und in jeder Phase fallen wichtige Daten in großer Menge an, die sorgfältig zusammengestellt und analysiert werden müssen, um sicherzustellen, dass das Produkt sicher bleibt.
Die Einhaltung von Vorschriften ist keine einmalige Sache, und ein effektives Lebenszyklusmanagement hilft, Verzögerungen zu vermeiden, die später teuer werden können. Diese Verzögerungen sind oft auf eine ineffektive Planung für unvorhergesehene Änderungen der Vorschriften oder Nichteinhaltung von Vorschriften zurückzuführen, die möglicherweise übersehen wurden. Regelmäßige Aktualisierungen wichtiger Dokumente wie CERs, PERs und PSURs stellen sicher, dass die Hersteller die sich entwickelnden gesetzlichen Anforderungen erfüllen und die Produktsicherheit aufrechterhalten. Das Lebenszyklusmanagement stellt sicher, dass die Hersteller von Anfang an für jede Phase vorgesorgt haben, so dass sie Fallstricke vermeiden und eine erfolgreiche Markteinführung und Langlebigkeit ihrer Produkte gewährleisten können.
Halten Sie sich an die Vorschriften?
Von Bandagen bis hin zu Implantaten ist die Medizinprodukteindustrie ein hochmoderner und kreativer Sektor, der eine Fülle von Perspektiven bietet. Trotz des starken Bestrebens der Hersteller, den Markt mit sicheren und hochwertigen Produkten zu versorgen, gibt es dennoch Unklarheiten. Die EU MDR ersetzte die Richtlinie über Medizinprodukte (MDD) und die Richtlinie über aktive implantierbare medizinische Geräte (AIMDD). Diese Verordnung wurde eingeführt, um strengere Kontrollen einzuführen, die Patientensicherheit zu verbessern und die Transparenz im Gesundheitswesen zu erhöhen. Die Unsicherheit über diese Normen ist groß, und wichtige Fragen der Einhaltung werden häufig übersehen. Hersteller von Medizinprodukten sollten jedoch Maßnahmen ergreifen, um Schwierigkeiten bei der Regulierung zu vermeiden.
Untersuchen wir die häufigsten Herausforderungen, mit denen Hersteller von Medizinprodukten konfrontiert sind
- Aufrechterhaltung von CAPA (Corrective and Preventive Action)
- Einhalten der Beschwerdeverfahren
- Befolgung der Vigilanzverfahren
- Klinische Bewertung und Überwachung nach dem Inverkehrbringen
- Verbindung zu den benannten Stellen
Bewährte Praktiken für die Einhaltung der Vorschriften
Um diese Herausforderungen zu bewältigen, haben wir bei Freyr
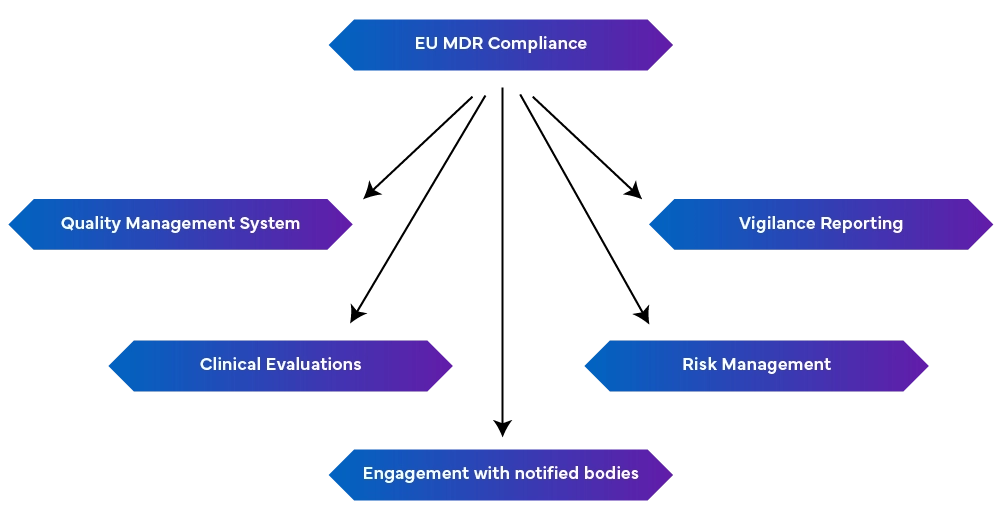
-einrobustes Qualitätsmanagementsystem (EN ISO 13485:2016): Dies umfasst Aspekte der Produktion, einschließlich der Einhaltung von Vorschriften, der technischen Dokumentation, der EU-Konformitätserklärungen und des Risikomanagements.
Vigilanz-Berichterstattung: Aufrechterhaltung der Wachsamkeitsberichterstattung als kontinuierlicher Prozess und nicht als einmalige Maßnahme.
- Proaktives Risikomanagement: Dadurch werden Risiken während des gesamten Lebenszyklus des Geräts identifiziert und gemindert, indem regelmäßig Aktualisierungen vorgenommen werden, um neu auftretende Risiken anzugehen.
- Durchführung von klinischen Bewertungen und Post-Market Surveillance: Dies geschieht durch den Nachweis der Sicherheit und Leistung des Produkts anhand klinischer Daten. Falls erforderlich, sollten klinische Prüfungen durchgeführt werden, und die klinischen Bewertungen sollten regelmäßig durch Daten aus der Überwachung nach dem Inverkehrbringen aktualisiert werden. Regelmäßige aktualisierte Sicherheitsberichte mit einer Zusammenfassung der Ergebnisse sind ebenfalls erforderlich.
- Verbindung zu benannten Stellen: Änderungen der Vorschriften können sich auf die MDR-Anforderungen auswirken. Daher ist es wichtig, eine gute Beziehung zu den benannten Stellen zu pflegen, damit Aktualisierungen und Änderungen umgehend vorgenommen werden können.
Wie ein Regulierungsexperte Ihnen helfen kann
Der Versuch, mit der sich ständig verändernden Regulierungslandschaft Schritt zu halten, kann schwierig sein. Warum lassen Sie sich also nicht von einem Experten durch dieses Labyrinth führen? Die Verwaltung der regulatorischen Anforderungen im Lebenszyklus eines Medizinprodukts ist nicht nur komplex, sondern auch ressourcenintensiv. Bei kleineren Unternehmen, deren interne Ressourcen in anderen Bereichen besser eingesetzt werden könnten, kann sich die Hilfe eines externen Partners für Regulierungsfragen als unverzichtbar erweisen. Sie bieten Fachwissen über die sich entwickelnden Vorschriften und stellen sicher, dass Ihre wichtigsten Berichte - wie CERs, PERs und PSURs - kontinuierlich aktualisiert werden und den Vorschriften entsprechen.
Sie können kostspielige Verzögerungen vermeiden, die Nichteinhaltung von Vorschriften verhindern und Ihr Genehmigungsverfahren rationalisieren. Darüber hinaus kann ein Regulierungsexperte maßgeschneiderte Lösungen für die spezifischen Anforderungen Ihres Produkts anbieten und sicherstellen, dass die Überwachung nach dem Inverkehrbringen, die Lückenanalyse und die gesamte Compliance-Dokumentation auf dem neuesten Stand sind. Ihre Mitwirkung kann den gesamten Prozess vereinfachen, die Risiken minimieren und sicherstellen, dass das Produkt die Sicherheits- und Leistungserwartungen erfüllen kann.
Freyr kann Ihnen bei all Ihren regulatorischen Anforderungen in Bezug auf das Lebenszyklusmanagement helfen. Reach Sie noch heute Kontakt mit us auf!









