Während innovative oder Markenarzneimittel zusätzliche Kosten für die Forschung und Entwicklung des Produkts von der Identifizierung des Moleküls bis zur Zulassung nach der Markteinführung verursachen, sind generische Arzneimittel relativ kostengünstig. Diese Therapien senken nicht nur die Gesamtkosten der Behandlung, sondern verbessern auch den Zugang der Patienten zu lebensrettenden Arzneimitteln erheblich. Da die Abhängigkeit von der Einfuhr generischer Antibiotika und von Arzneimitteln zur Behandlung seltener Krankheiten während der Pandemie die Verfügbarkeit dieser Arzneimittel weltweit beeinträchtigte, führen die Gesundheitsbehörden neue Richtlinien zur Unterstützung der lokalen Arzneimittelhersteller ein.
Seit 1993 verfolgt die Handelsorganisation Medicines for Europe, früher bekannt als European Generics Medicine Association (EGA), konsequent ihr Ziel, der europäischen Patientenbevölkerung kostengünstige Therapien nahezubringen. In den letzten zehn Jahren hat sie 67 % aller Arzneimittel erfolgreich nach Europa geliefert und den Zugang der Patienten zu 100 % in sieben (07) wichtigen therapeutischen Bereichen verbessert. Die "strategische Autonomie" der europäischen Gesundheitsbehörden nach dem Brexit ist eine unmittelbare Voraussetzung, um den Wettbewerbsnachteil der europäischen Generika- und Biosimilars-Hersteller wirksam zu beseitigen. Mit dem Auftreten der COVID-19-Pandemie brachen die Kapazitäten der globalen Lieferkette unter dem Druck der Nachfrage nach Arzneimitteln zusammen. Lebensrettende Medikamente zur Linderung chronischer Krankheiten verschwanden aus den Regalen der lokalen Apotheken. Um Hürden bei patentgeschützten Arzneimitteln zu überwinden und lokale Produktionskapazitäten aufzubauen, um den Zugang der Patienten zu verbessern, verabschiedete der EU-Rat eine Verordnung, die eine Ausnahme für ein Originalmolekül durch ein ergänzendes Schutzzertifikat (SPC) vorsieht. Die Bestimmung erleichtert die Herstellung von Generika und Biosimilars vor Ablauf des Patentschutzes für die Bevorratung oder den Export. Die Ausnahme gilt jedoch nur unter den folgenden Umständen.
- Die hergestellten Generika oder Biosimilars sind ausschließlich für den Export in ein anderes Land bestimmt, in dem das Patent für das Arzneimittelmolekül nicht besteht oder abgelaufen ist, oder für die Bevorratung innerhalb der noch verbleibenden Patentlaufzeit von sechs (06) Monaten.
- Gemäß der Vorschrift hat der Hersteller die Informationen an die örtliche Gesundheitsbehörde und den Inhaber des SPC vor drei (03) Monaten übermittelt.
- Der Hersteller hat alle von der Vermarktung des Produkts betroffenen Akteure informiert.
- Der Hersteller hat dafür gesorgt, dass auf dem Etikett des Arzneimittels angegeben ist, dass es nur für den Export bestimmt ist.
In der Tat
Seit der Erteilung der bedingten Marktzulassung für COVID-19-Impfstoffe in der EU hat der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Arzneimittel-Agentur innerhalb eines Jahres vier (04) Standorte für die Impfstoffproduktion genehmigt; zwei (02) in der Schweiz und zwei (02) in den USA. Diese Entscheidungen zugunsten einer Ausweitung der Produktionsstätten werden die Produktionskapazitäten für Impfstoffe verbessern und sie für die europäische Bevölkerung leichter zugänglich machen.
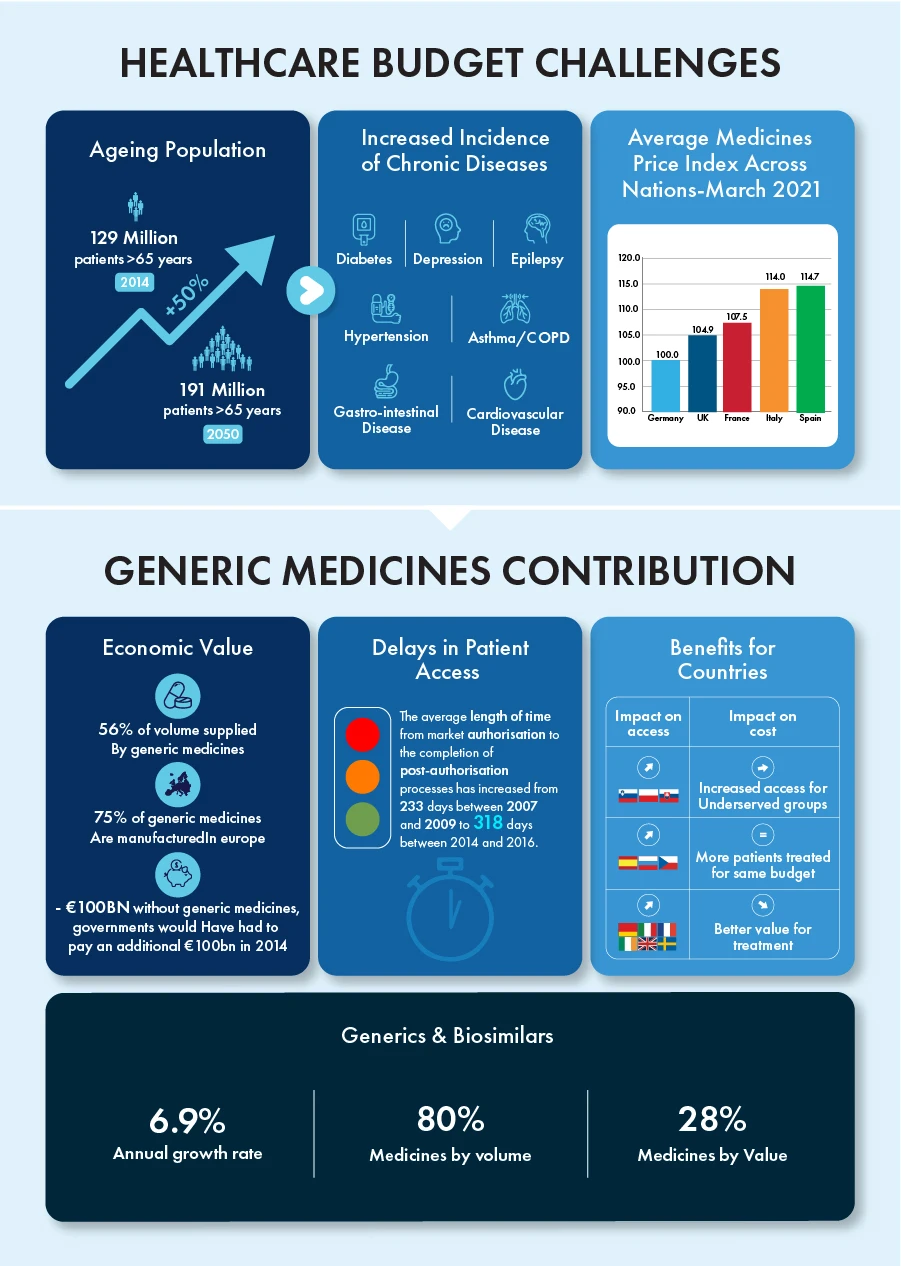
Generika und Biosimilars haben in den letzten zehn Jahren im Alleingang zu einer jährlichen Wachstumsrate von 6,9 % beigetragen, während sie mengenmäßig 80 % und wertmäßig 28 % aller Arzneimittel ausmachten. Bis 2023 läuft der Patentschutz für bestimmte Biologika im Wert von rund 90 Milliarden Euro aus, wodurch ein Wettbewerbsumfeld für diese Produkte mit enormem Wachstumspotenzial entsteht.
Die Umsetzung einer SPC-Ausnahmeregelung würde der Europäischen Union folgende Vorteile bringen:
- Das bedeutet zusätzliche 90,5 Mrd. € pro Jahr.
- Schaffung von 25.000 neuen Arbeitsplätzen, darunter 2.000 direkte Arbeitsplätze für die API-Branche in der EU. Die Initiative wird member states helfen, 3,1 Mrd. EUR an Gesundheitsausgaben member states .
- Bevorratung preiswerterer Alternativen zu patentierten Arzneimitteln von Innovatoren, damit diese unmittelbar nach dem Auslaufen des geistigen Eigentums auf den Markt kommen können, was den Zugang der Patienten verbessert.
Für einen Arzneimittelhersteller mit Sitz außerhalb der Europäischen Union ist die Umsetzung der SPC-Ausnahmeregelung eine der lohnendsten Initiativen zugunsten von Generika. Da die EU-Gesundheitsbehörde Arzneimittel für den menschlichen und tiermedizinischen Gebrauch durch ein zentralisiertes oder dezentralisiertes Verfahren reguliert, kann die Navigation durch spezifische lokale Anforderungen überwältigend sein. Ein Experte, der mit den lokalen Anforderungen hinsichtlich verschiedener Anträge und Lizenzdokumente vertraut ist, kann Ihnen dabei helfen, sich auf die wesentlichen Produktionsprotokolle zu konzentrieren, anstatt sich mit komplexen regulatorischen Hindernissen aufzuhalten. Entdecken Sie Ihr Geschäftspotenzial neu, indem Sie Compliance und Qualität erleben. Kontaktieren Sie Freyr.









