Überblick über die Registrierung von Medizinprodukten in Argentinien
Argentinien ist eines der sich schnell entwickelnden Länder Lateinamerikas, das mit seinem Gesundheitssystem, das für sein Engagement für die Sicherheit der Patienten und die hohe Qualität der medizinischen Dienstleistungen bekannt ist, Chancen für Medizinprodukteunternehmen bietet. Die Zulassung von Medizinprodukten in Argentinien wird von der Aufsichtsbehörde - der Nationalen Behörde für Arzneimittel, Lebensmittel und Medizinprodukte (ANMAT) - überwacht.

Aufsichtsbehörde: Nationale Behörde für Arzneimittel, Lebensmittel und Medizinprodukte (ANMAT)
Vorschriften: Disposition 2318/2002 und Disposition 727/2013
Regulierungspfad: Elektronisches System für die webgestützte Benachrichtigung von Geräten (WAND)
Bevollmächtigter Vertreter: Bevollmächtigter Vertreter Argentiniens (AAR)
QMS-Anforderung: ISO 13485 (ANMAT MDS), und MDSAP (angeschlossenes Mitglied)
Bewertung der technischen Daten: Nationale Behörde für Arzneimittel, Lebensmittel und Medizinprodukte (ANMAT)
Kennzeichnungsvorschriften: Anhang III.B der Bestimmung 2318/2002 und Anhang V der Bestimmung 727/2013.
Format der Einreichung: Elektronisch (HELENA-Portal)
Sprache: Spanisch
Klassifizierung von Medizinprodukten in Argentinien
Im Rahmen des ANMAT-Regulierungsverfahrens besteht der erste Schritt bei der Festlegung des Registrierungsverfahrens und der Einhaltung der argentinischen Vorschriften darin, die Klassifizierung des Medizinprodukts zu bestimmen. In Argentinien werden die Produkte je nach Risiko in vier (04) Klassen eingeteilt (Klasse I-IV).
| Medizinische Geräteklasse | Kriterien |
|---|---|
| Klasse I | Geringes Risiko |
| Klasse II | Geringes bis mäßiges Risiko |
| Klasse III | Hohes bis mäßiges Risiko |
| Klasse IV | Hohes Risiko |
| IVD-Klasse | Kriterien |
|---|---|
| Klasse A | Diagnose von nicht-infektiösen oder nicht-übertragbaren Krankheiten. |
| Klasse B | Diagnose von Infektionskrankheiten mit Ausnahme derjenigen, die zur Klasse C gehören. |
| Klasse C | Diagnose von sexuell übertragbaren Infektionskrankheiten, die durch Blut oder Blutderivate übertragen werden, sowie zur Identifizierung von Blutgruppen. |
| Klasse D | Zur Selbsteinschätzung. |
Bevollmächtigter Vertreter Argentiniens (AAR)
Der Zulassungsinhaber eines Medizinprodukts in Argentinien ist rechtlich für die Zulassung und das Inverkehrbringen des Produkts in dem Land verantwortlich. Dies kann der Hersteller des Produkts oder ein lokaler Bevollmächtigter (AAR) in Argentinien sein, der im Namen des Herstellers handelt.
Alle in Argentinien vermarkteten Medizinprodukte müssen bei der ANMAT registriert werden. Das Registrierungsverfahren kann komplex und zeitaufwendig sein, weshalb ausländischen Herstellern oft empfohlen wird, einen AAR zu beauftragen, der sie unterstützt.
ANMAT Registrierung von Medizinprodukten
Das ANMAT-Registrierungsverfahren für Medizinprodukte ähnelt dem brasilianischen Melde- und Registrierungsverfahren, wobei der Umfang der für die Zulassung erforderlichen Prüfungen je nach Produktklassifizierung (Klasse I, II, III und IV) zunimmt. Alle Hersteller von Medizinprodukten müssen auch das ANMAT-MDS einhalten, das das argentinische Äquivalent zum BGMP ist und ebenfalls mit der ISO 13485:2016 übereinstimmt.
Prozessablauf
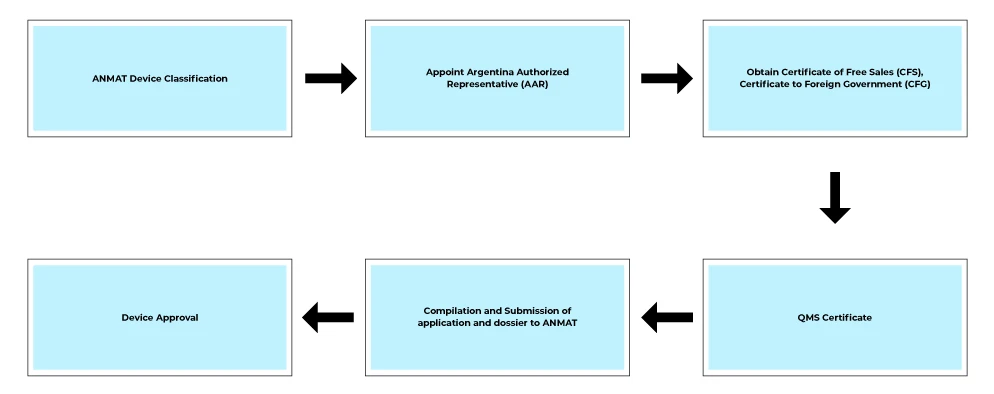
Dienstleistungen nach der Zulassung
Freyr ausländische Hersteller beim end-to-end Lebenszyklusmanagement end-to-end , einschließlich Aktivitäten nach der Zulassung, wie z. B. –
- Änderungsmanagement nach der Zulassung - Änderungen bestehender Zulassungen für Medizinprodukte, z. B. Hinzufügung neuer Varianten, von Zubehör und neuen Anwendungsgebieten.
- Aufrechterhaltung von Zulassungen und Registrierung durch rechtzeitige Zahlung von Verwaltungs- und Registrierungsgebühren.
- Erneuerung von Lizenzen.
- Verbindung zwischen der ANMAT und dem Hersteller.
- Meldung unerwünschter Ereignisse.
- Verwaltung der Einfuhren.
Freyr Hersteller zunächst bei der Einstufung ihrer Produkte. Freyr Kunden dabei, den regulatorischen Weg zu beschreiten und Zertifizierungen zu erhalten, indem es sie bei der Bewältigung der damit verbundenen regulatorischen Hürden unterstützt. Mit seiner bewährten Expertise bei der Markteinführung zahlreicher Produkte in der Region Freyr end-to-end Dienstleistungen für Medizinprodukte.
Zusammenfassung
| Klasse von Geräten | Registrierungspfad (Benachrichtigung oder vollständige Registrierung) | Zeitpläne der Gesundheitsagentur | Gültigkeitsdauer der Registrierung (Jahre) |
|---|---|---|---|
| Geräte der Klasse I | Vollständige Registrierung | 4- 6 Monate | 5 Jahre |
| Geräte der Klasse II | Vollständige Registrierung | 4- 6 Monate | 5 Jahre |
| Produkte der Klasse III | Vollständige Registrierung | 6-8 Monate | 5 Jahre |
| Geräte der Klasse IV | Vollständige Registrierung | 6-8 Monate | 5 Jahre |
*Bitte beachten Sie, dass Faktoren wie Bandbreitenbeschränkungen, Aktualisierungen von Vorschriften und andere Variablen zu einer Verlängerung der Fristen der Gesundheitsbehörde führen können.
Freyr-Podcasts
- Regulatory Intelligence Report Services.
- Offizielle Klassifizierungsdienste.
- Zusammenstellung der technischen Dokumente.
- Dienste zur Geräteregistrierung.
- Dienstleistungen des Bevollmächtigten Vertreters Argentiniens (AAR).
- Dienstleistungen für die Einfuhr.
- Betriebserlaubnisse und Genehmigungen.
- Übersetzungsdienste.
- Etikettierung und Artwork .
- Dienstleistungen zur Identifizierung und Qualifizierung von Vertriebspartnern.
- Überwachung nach dem Inverkehrbringen.
- Dienstleistungen zur Lizenzverlängerung und -übertragung.