Überblick über die Registrierung von Medizinprodukten in Kolumbien
Das kolumbianische Gesundheitssystem ist bekannt für sein Engagement für die Sicherheit der Patienten und die Qualität der medizinischen Dienstleistungen. Die Zulassung von Medizinprodukten erfolgt über das INVIMA (Nationales Institut für Lebensmittel- und Arzneimittelüberwachung). INVIMA ist die zuständige Behörde für die Registrierung von Medizinprodukten in Kolumbien.

Regulierungsbehörde: INVIMA (das Nationale Institut für Lebensmittel- und Arzneimittelüberwachung)
Verordnung: Dekret 4725/2005
Regulierungspfad: Registrierung des Geräts
Bevollmächtigter Vertreter: Rechtsvertreter für Kolumbien
QMS-Anforderung: ISO 13485:2016 / MDSAP
Bewertung der technischen Daten: INVIMA
Kennzeichnungsvorschriften: Die Beschriftungsunterlagen müssen in spanischer Sprache abgefasst sein.
Gültigkeit der Lizenz: 10 Jahre
Format der Einreichung: Elektronisch
Kolumbien Klassifizierung von Medizinprodukten
| Klassifizierung von Medizinprodukten | |
|---|---|
| Klasse I (Geringstes Risiko) | |
| Klasse IIa | |
| Klasse IIb | |
| Klasse III (höchstes Risiko) | |
Rechtsvertreter für Kolumbien
Um als gesetzlicher Vertreter in Kolumbien tätig zu sein, muss man entweder die kolumbianische Staatsbürgerschaft besitzen oder über die erforderliche gesetzliche Genehmigung verfügen, um als ausländischer Staatsangehöriger in Kolumbien zu leben und zu arbeiten. Ein gesetzlicher Vertreter kann bei allen Registrierungsverfahren in Kolumbien behilflich sein und als Bindeglied zwischen dem Unternehmen und INVIMA, der lokalen Regulierungsbehörde, fungieren.
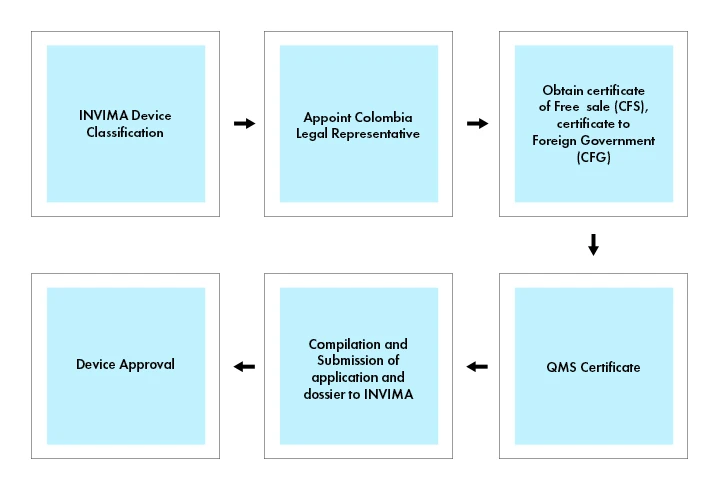
Kolumbien Registrierung von Medizinprodukten
Medizinprodukte und IVDs unterliegen einem Registrierungsverfahren, so dass Medizinprodukte bei INVIMA registriert sein müssen, um in Kolumbien vermarktet werden zu können.
Um ein Medizinprodukt in Kolumbien zu vermarkten, ist ein Certificate of Free Sale (CFS) oder ein Certificate to Foreign Government (CFG) erforderlich, das von der zuständigen Aufsichtsbehörde des Herkunftslandes oder eines anerkannten Referenzlandes (z. B. Kanada, Japan, Australien, die Europäische Union und die Vereinigten Staaten) ausgestellt wird. Das Certificate of Free Sale oder Certificate to Foreign Government dient als Nachweis, dass das Medizinprodukt die erforderlichen Sicherheits- und Qualitätsstandards für den Verkauf in Kolumbien erfüllt.
Prozessablauf
Management des Lebenszyklus von Geräten nach der Zulassung
Freyr ausländische Hersteller beim end-to-end Lebenszyklusmanagement end-to-end , einschließlich Aktivitäten nach der Zulassung, wie zum Beispiel:
- Änderungsmanagement nach der Zulassung - Änderungen bestehender Zulassungen für Medizinprodukte, z. B. Hinzufügung neuer Varianten und Zubehörteile, Hinzufügung neuer Anwendungsgebiete usw.
- Aufrechterhaltung von Zulassungen und Registrierung durch rechtzeitige Zahlung von Verwaltungs- und Registrierungsgebühren
- Erneuerung von Lizenzen
- Verbindung zwischen der INVIMA und dem Hersteller
Zusammenfassung
| Klassifizierung von Medizinprodukten | Neue Lizenzen und Verlängerungen | ||
|---|---|---|---|
| Neue Registrierung | Abänderung | Erneuerung | |
| Klasse I | 4-6 Monate | 2-3 Monate | 4-6 Monate |
| Klasse IIa | 4-6 Monate | 2-3 Monate | 4-6 Monate |
| Klasse IIb | 4-6 Monate | 2-3 Monate | 4-6 Monate |
| Klasse III | 4-6 Monate | 2-3 Monate | 4-6 Monate |
| Gebühren für die Registrierung | |||||
|---|---|---|---|---|---|
| Neue Lizenzen und Verlängerungen | Technische Anpassungen | Administrative Modifikationen | |||
| Klasse I & Klasse IIa | Klasse IIb und Klasse III | Klasse I & Klasse IIa | Klasse IIb und Klasse III | Klasse I & Klasse IIa | Klasse IIb und Klasse III |
| $ 690,00 | $ 776,00 | $ 196,00 | $ 196,00 | $ 153,00 | $ 153,01 |
Freyr-Podcasts
- Regulatorische Due Diligence
- Offizielle Klassifizierung
- Registrierung des Geräts
- Kolumbien Registrierungsinhaber
- Unterstützung bei der Etikettierung
- Unterstützung bei der Übersetzung
- Identifizierung und Qualifizierung von Händlern
- Post-Marketing-Überwachung
- Änderungsmanagement nach der Genehmigung
- Erneuerung und Übertragung von Lizenzen
- Einreichung und Verbindung mit dem INVIMA